Una forma alternativa de definir la sal es describirla como una forma de sal de ácido carbónico y un antiácido con acción quelante de fosfato. El carbonato de aluminio puro es extremadamente raro en la naturaleza; se encuentra más comúnmente como el mineral de carbonato de aluminio y sodio dawsonita y los minerales de carbonato de aluminio básico hidratado escarbroita e hidroscarbroita.
¿Qué es el carbonato de aluminio?
El carbonato de aluminio es un carbonato de una sal de aluminio, que no se encuentra en la naturaleza. Es posible producirlo a alta presión de dirust de carbono ya temperaturas cercanas a 0°C.
El almacenamiento de carbonato de aluminio requeriría el desarrollo de un mecanismo muy complicado que protegiera al producto químico de cualquier fuerza externa. El carbonato de aluminio es un carbonato de aluminio. Además, es una fuente de aluminio insoluble en agua que puede convertirse fácilmente en otros compuestos de aluminio.
La fórmula química del carbonato de aluminio es Al 2 (CO 3 ) 3 .
Propiedades del Carbonato de Aluminio
Propiedades físicas
Los atributos físicos de una sustancia química incluyen su densidad, punto de fusión, temperatura de ebullición y apariencia física. Algunas de las características físicas del compuesto también se ven afectadas por la fórmula de carbonato de aluminio.
La siguiente es una lista de propiedades físicas:
- El carbonato de aluminio tiene una densidad de 1,5 g/cm3
- La masa molar del compuesto es 96,09 g/mol.
- Son solubles en agua.
- El punto de fusión del carbonato de aluminio es de 58 °C.
- En el punto de ebullición, se descompone.
- La apariencia física del carbonato de aluminio podría describirse como polvorienta y blanca. Parecen polvo blanquecino.
Propiedades químicas
Las propiedades químicas de un compuesto brindan información sobre la fórmula química del carbonato de aluminio, el peso molecular, el tipo de reacción, los tipos de enlaces involucrados y otros aspectos de un compuesto.
Las siguientes son algunas de las propiedades químicas del compuesto:
- Tricarbonato de dialuminio es el término IUPAC para carbonato de aluminio.
- El carbonato de aluminio tiene un peso molecular de 233,99.
- El número de aceptor de enlaces de hidrógeno del compuesto es 9.
- La cantidad de donantes de enlaces de hidrógeno es cero. No hay bonos que se puedan rotar.
- El compuesto químico tiene una complejidad de 18,8.
- Las características de la sal son de carácter básico.
Estructura del Carbonato de Aluminio
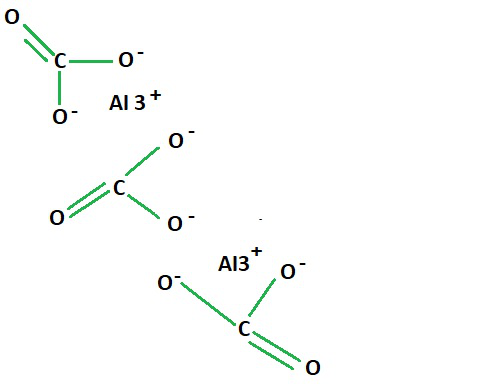
Carbonato de aluminio
Preparación de Carbonato de Aluminio
No hay indicios de que la producción de carbonato de aluminio pueda ocurrir en procesos de doble desplazamiento. Además, los carbonatos solubles pueden precipitar el hidrrust de aluminio, dando como resultado la producción de dirust de carbono. Esto se debe al hecho de que el carbonato soluble se considera alcalino. Sobre todo, la reacción del sulfato de aluminio con bicarbonato de sodio produce dirust de carbono e hidrrust de aluminio. Además, el hidrrust de aluminio inhibe la producción de espuma. Esta reacción también fue la inspiración para el desarrollo de uno de los primeros extintores de incendios.
Usos del carbonato de aluminio
- El carbonato de aluminio, como el rust de aluminio y el hidrrust de aluminio, es un medicamento que se une al fosfato. Ocasionalmente, los veterinarios administran este medicamento a perros y gatos para unir el fosfato intestinal.
- Este medicamento inhibe la absorción del fosfato de la dieta y reduce la absorción del fósforo pancreático. Además, rara vez se usa en humanos. Esto se debe a las preocupaciones sobre su toxicidad. Los perros y gatos no tienen una reacción dañina a su presencia.
- El carbonato de aluminio es útil para prevenir la formación de cálculos urinarios en humanos. También es útil como tratamiento medicinal en situaciones de exceso de acidez estomacal. En algunas de estas situaciones pueden ocurrir inflamaciones y ulceraciones. El carbonato de aluminio simplemente trata los síntomas de la enfermedad; no tiene impacto en la enfermedad en sí.
- Además, este medicamento se puede tomar en forma de tableta o líquido. Sobre todo, se debe tener precaución al tomar carbonato de aluminio, y se debe consultar con un profesional médico antes de usarlo. Aquellos que sufren de problemas renales deben evitarlo absolutamente. Además, el carbonato de aluminio permite regular los niveles de fosfato en el organismo.
Ejemplos de preguntas
Pregunta 1: ¿El carbonato de aluminio es soluble en agua?
Responder:
El carbonato de aluminio básico es una fuente de aluminio insoluble en agua que se puede transformar fácilmente en otros compuestos de aluminio como el rust mediante calentamiento (calcinación).
Pregunta 2: ¿Cuál es la fórmula y la valencia del rust de aluminio?
Responder:
La valencia del aluminio es +3 y la del rust es -2. Por lo tanto, la fórmula química del rust de aluminio es Al 2 O 3 .
Pregunta 3: ¿Cuál es el contenido de iones del carbonato de aluminio?
Responder:
Como se ve en la fórmula estructural del carbonato de aluminio, dos iones de aluminio están presentes en el enlace entre los tres grupos carboxílicos que constituyen la fórmula de aluminio y carbonato.
Pregunta 4: ¿Cuál es el propósito de usar aluminio en el tratamiento del agua?
Responder:
El aluminio se usa en el tratamiento del agua para eliminar los gérmenes que causan enfermedades y otros contaminantes del agua potable que podrían dañar su salud. Cuando se trata adecuadamente, la cantidad de aluminio residual que queda en el agua debe ser comparable o inferior a la del agua no tratada.
Pregunta 5: ¿El aluminio es tóxico en el agua?
Responder:
La EPA emitió inicialmente pautas de aluminio en 1988 para salvaguardar la vida acuática de los efectos adversos de la toxicidad del aluminio en las aguas dulces.
El aluminio puede afectar la capacidad de un organismo acuático para controlar las concentraciones de sal y obstruir las branquias de los peces, lo que podría provocar la muerte o afectar el desarrollo y la reproducción.
Publicación traducida automáticamente
Artículo escrito por saurabh1990aror y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA