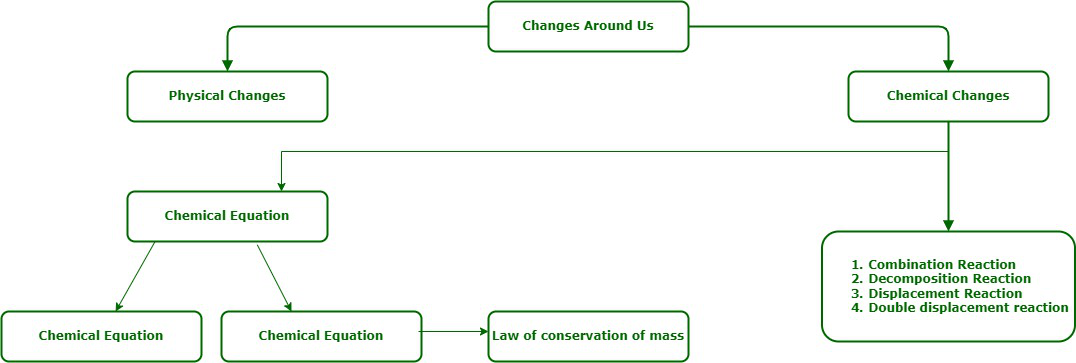
Una reacción química es un proceso en el que los enlaces dentro de los átomos reactivos se rompen y los enlaces sustituyentes dentro de los átomos del producto se cristalizan para cristalizar un sustituyente. El método de representar una reacción química con la ayuda de símbolos y fórmulas de las sustancias involucradas en ella se llama reacción química. Las reacciones químicas están relacionadas con los cambios químicos. Mientras ocurre un cambio químico, tiene lugar una reacción química. Las reacciones químicas suelen ser irreversibles y se forma un nuevo producto. Los átomos se reorganizan durante una reacción química.
- La sustancia que se combina o reacciona se conoce como reactivo .
- La nueva sustancia producida en una reacción se llama producto .
Una ecuación química es un método conciso para representar una reacción química.
Las características de las reacciones químicas son,
- evolución del gas
- Formación de un precipitado
- cambio de color
- Cambio de temperatura
- Cambio de estado
Ecuaciones químicas balanceadas y no balanceadas
- En una ecuación química balanceada, los reactivos y los productos tienen el mismo número de átomos de diferentes elementos.
- En una ecuación química desequilibrada, hay números desiguales de átomos de uno o más elementos en los reactivos y productos.
- En una ecuación química balanceada, los reactivos y los productos tienen masas iguales de elementos diferentes.
- En una ecuación no balanceada, los reactivos y los productos tienen masas diferentes de elementos diferentes.
- El número de átomos de diferente tipo en los reactivos debe ser igual al número de átomos del mismo tipo en los productos.
- Las ecuaciones químicas están balanceadas para satisfacer la ley de conservación de la masa en una reacción química.
Nunca cambies la fórmula de un elemento o compuesto para balancear una ecuación.
El proceso de igualar el número de diferentes tipos de átomos en ambos lados de una ecuación se llama equilibrio de ecuaciones.
La ecuación que da más información sobre la reacción química se llama ecuación más informativa o informativa. Una reacción química se puede hacer más informativa de tres maneras:
- Indicando los “ estados físicos ” de los reactivos y productos.
- Indicando el “ cambio de calor ” que tiene lugar en la reacción.
- Indicando las “ condiciones ” en las que tiene lugar la reacción.
Ejemplo importante sobre la escritura de ecuaciones químicas balanceadas
Se deben seguir los siguientes pasos para escribir ecuaciones para ecuaciones químicas:
| Paso 1. | Escribe la reacción química en forma de ecuación verbal con los reactivos a la izquierda y los productos a la derecha. |
| Paso 2. | Sustituye los símbolos y fórmulas de todos los reactivos y productos en la ecuación de palabras. |
| Paso 3. | Equilibre la ecuación multiplicando los símbolos y fórmulas por el menor número posible de dígitos. |
| Paso 4. | Sin embargo, haga que la ecuación sea más informativa indicando los cambios de temperatura, si es posible, denotando los estados físicos de los reactivos y productos. Sin embargo, este paso se puede evitar si no tiene suficiente información sobre los estados físicos, las fluctuaciones de calor y las condiciones de reacción. |
Teniendo estas cosas en mente, resolvamos un ejemplo:
Ejemplo: Escriba una ecuación balanceada para la siguiente reacción: El metano se quema en oxígeno para formar dirust de carbono y agua.
Solución:
Paso 1 : Escriba la reacción química en forma de ecuación verbal con los reactivos a la izquierda y los productos a la derecha.
Esta reacción se puede escribir como una ecuación de un término:
Dirust de carbono + Agua → Metano + Oxígeno
- La fórmula del metano es CH 3
- La fórmula del oxígeno es O₂
- La fórmula del dirust de carbono es CO₂
- la formula del agua es H₂O
Paso 2: Sustituya los símbolos y fórmulas de todos los reactivos y productos en la ecuación de palabras.
Al escribir las fórmulas de todas las sustancias en la ecuación verbal anterior, obtenemos:
CH 4 + O 2 → CO 2 + H₂O
Calculemos la estructura de diferentes átomos en los reactivos y productos:
en reactivos
en productos
Número de átomos de C 1
1
Número de átomos de H 4
2
Número de átomos de O 2
3
Paso 3: Balancee la ecuación multiplicando los símbolos y fórmulas por el menor número posible de dígitos.
La composición de los átomos de carbono es indistinguible en ambos lados (1 cada uno) pero la composición de los títulos de hidrógeno no es igual a la de los átomos de oxígeno del cobre. Hay 4 átomos de hidrógeno en el lado del reactivo pero solo 2 átomos de hidrógeno en el lado del producto. en el lado derecho. Para depositar 4 átomos de hidrógeno a la derecha, multiplicamos H₂O por 2 y escribimos 2H 2 O. Por lo tanto,
CH 4 + 2O 2 → CO 2 + H₂O
Contando nuevamente el número de varios átomos en ambos lados, obtenemos:
en reactivos
en productos
Número de átomos de C
1
1
Número de átomos de H
4
4
Número de átomos de O
2
4
Ahora, solo el número de átomos de oxígeno es desigual. Hay 2 átomos de oxígeno a la izquierda pero 4 a la derecha. Para tener 4 átomos de oxígeno a la izquierda, multiplicamos O₂ por 2 y escribimos 2O₂.
CH 4 + 2O 2 →CO 2 + 2H₂O
Contemos el número de átomos diferentes en ambos lados una vez más
en reactivos
en productos
Número de átomos de C
1
1
Número de átomos de H
4
4
Número de átomos de O
4
4
En esta ecuación química, hay igual número de diferentes tipos de átomos en los reactivos y productos, por lo que es una ecuación balanceada.
Descripción detallada para una mejor comprensión del ejemplo anterior.
La ecuación anterior se puede hacer más informativa al indicar los estados físicos de los reactivos y productos, así como los cambios de calor que tienen lugar en la reacción, como se explica a continuación:
- El metano es un gas- CH 4 (g)
- El oxígeno es un gas- O₂(g)
- El dirust de carbono es un gas- CO₂ (g)
¿Qué pasa con el estado físico del H₂O?
Si la reacción tiene lugar en un medio acuoso, entonces el H₂O está en estado líquido y lo describimos como HO(1). Si la reacción tiene lugar en fase de vapor, entonces el H₂O está en estado gaseoso y se denota como H₂O (g). En este caso, el gas metano se quema en gas oxígeno para formar gas de dirust de carbono y vapor o corriente de agua. Así que el agua aquí está en estado gaseoso y es H₂O (g). Si ponemos los estados físicos de todos los reactivos y productos, entonces la ecuación se puede escribir como-
CH 4 (g) + 2O 2 (g) → CO 2 (g) +2H 2 O (g)
Ahora, el calor que tiene lugar en esta reacción cambia. Cuando el metano se quema en oxígeno para formar dirust de carbono y agua, también se produce mucho calor, por lo que es una reacción exotérmica. Una reacción exotérmica se indica escribiendo un signo «+calor» en el lado del producto. Entonces, la ecuación anterior finalmente se puede escribir como:
CH 4 (g) + 2O 2 (g) → CO 2 (g) +2H 2 O(g) + Calor
Esta ecuación ahora brinda los estados físicos de esos reactivos y productos, así como los cambios de calor que tienen lugar en la reacción, por lo que es una ecuación más informativa.
Ejemplos de preguntas
Pregunta 1: Enumere cuatro cambios a su alrededor a través de los cuales podemos determinar si se ha producido una reacción química o no.
Responder:
- respiración de los animales,
- digestión de los alimentos,
- Quema de carbón, y
- Oxidación del hierro.
Pregunta 2: Mencione tres observaciones cualesquiera que ayuden a determinar si se ha producido o no una reacción química. Escriba una actividad que pueda justificar al menos dos de los comentarios enumerados.
Responder:
Observaciones :
- Cambio de estado,
- cambio de color,
- Evolución de un gas,
- Cambio de temperatura.
Actividad :
- Algunos gránulos de zinc se toman en un matraz cónico.
- Se vierte sobre ella una pequeña cantidad de ácido clorhídrico diluido.
- Se observa que los gránulos de zinc comienzan a disminuir de tamaño y se libera gas hidrógeno.
- La temperatura del matraz también aumenta ligeramente.
Pregunta 3: Mencione tres formas en las que una ecuación química general puede hacerse más informativa.
Responder:
Hay tres formas de hacer que una ecuación química general sea más informativa:
- Al equilibrar la reacción química, el número de átomos de cada reactivo y producto puede igualarse.
- Se puede obtener más información sobre los estados físicos de los reactivos y productos consultando sus estados físicos (s, l, g, aq).
- El calor debe especificarse a favor de los reactivos o productos para identificar una reacción endotérmica o exotérmica.
Pregunta 4: Seema compró el paquete de papas fritas y lo abrió. De repente llegó su amigo Shanu. Empezó a jugar y se olvidó de comer papas fritas. Al día siguiente, cuando comió las papas fritas, sintió que el sabor no era bueno y no se sentía bien. Le pidió a su madre que lo llevara al médico. El médico le dijo que esto sucedió por comer papas fritas rancias. Le dio medicinas por lo que Seema mejoró en pocos días.
(a) ¿Por qué las papas fritas se mantienen frescas por más tiempo en paquetes sellados?
(b) ¿Por qué se estropearon los chips de paquetes abiertos?
(c) ¿Qué valor aprende de este pasaje?
Responder:
(a) Esto se debe a que los paquetes sellados de chips generalmente se llenan con un gas como el nitrógeno, que evita que los chips se oxiden.
(b) Las grasas y los aceites presentes en el paquete abierto de patatas fritas se oxidan. Se vuelven rancios y su olor y sabor cambian.
(c) Los alimentos deben almacenarse en recipientes herméticos o en el refrigerador para evitar la oxidación de las grasas y aceites presentes en ellos. Una vez que los paquetes de papas fritas o el alimento se estropean, su olor y sabor cambian. No se deben comer porque no son buenos para nuestra salud.
Pregunta 5: ¿Cuál es el estado físico del H₂O en una reacción química?
Responder:
Si la reacción tiene lugar en un medio acuoso, entonces el H₂O está en estado líquido y lo describimos como HO(1). Si la reacción tiene lugar en fase de vapor, entonces el H₂O está en estado gaseoso y se denota como H₂O (g).
Publicación traducida automáticamente
Artículo escrito por tanushree7252 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA