Los aldehídos y las cetonas son moléculas químicas con un grupo carbonilo (>C= O). Como resultado, se les conoce como compuestos carbonílicos. Debido a que el grupo carbonilo es común en aldehídos y cetonas, sus métodos de síntesis y características son bastante similares.
Las moléculas de carbonilo se encuentran naturalmente en los carbohidratos y las proteínas de los ácidos nucleicos de las plantas y los animales. Cumplen un papel crucial en los procesos metabólicos que mantienen la vida en marcha. Aportan aroma y sabor a la naturaleza y también se encuentran en una variedad de medicamentos y textiles. Almendras (benzaldehído), canela (cinamaldehído), vaina de vainilla (vainillina), alcanfor (del árbol de alcanfor), aceite de citronela (citronelal), vitamina K y muchos otros ingredientes naturales, incluidos los compuestos carbonílicos esenciales.
Los átomos de carbono están conectados al oxígeno por un doble enlace en un grupo carbonilo, mientras que las dos valencias restantes están satisfechas por átomos de hidrógeno o grupos alquilo. El carbono carbonilo está conectado a un átomo de hidrógeno y un grupo aliado en los aldehídos, pero a dos grupos alquilo distintos en las cetonas. El carbono carbonílico está unido a dos átomos de hidrógeno en el formaldehído. La diferencia en la estructura influye en las características, como la forma en que los aldehídos son más reactivos que las cetonas en los procesos de adición nucleofílica y la rapidez con la que se oxidan los aldehídos. El átomo de carbono del carbonilo está conectado a un grupo alquilo y un grupo (-OH) en los ácidos carboxílicos. El grupo carbonilo se encuentra en las sustancias químicas enumeradas a continuación.
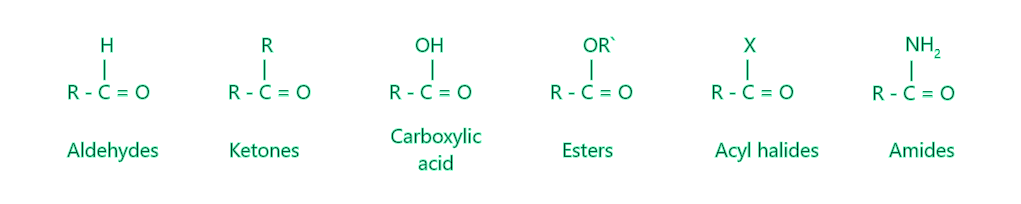
Estructura del grupo funcional carbonilo
El carbono del grupo carbonilo tiene hibridación sp 2 y se une a tres átomos adicionales en aldehídos y cetonas. Los átomos de carbono crean tres enlaces sigma (σ) con ángulos de enlace de 120° que están todos en el mismo plano. Un enlace sigma se establece con un átomo de oxígeno y los otros dos con átomos de hidrógeno y/o carbono. Para producir el enlace pi (π), el carbono orbital 2p no hibridado restante coincide con el orbital 2p del oxígeno. Como resultado, el carbono y el oxígeno están conectados por un doble enlace. El átomo de oxígeno transporta dos pares de electrones solitarios.

Estructura del grupo carbonilo
El enlace carbonilo es más poderoso. En comparación con el doble enlace de los alquenos, este enlace es más corto y más polarizado. Debido a que el oxígeno es más electronegativo que el carbono, el doble enlace del grupo carbonilo es polar y tiene un momento dipolar. La polarización se suma a la reactividad de aldehídos y cetonas.
Reacciones de adición nucleófila de aldehídos y cetonas
Mecanismo
El oxígeno tiene mayor electronegatividad que el carbono, por lo que el enlace C=O en aldehídos y cetonas está polarizado.
Los electrones son muy atraídos por el oxígeno. El átomo de oxígeno recibe una carga negativa parcial (δ – ), mientras que el átomo de carbono recibe una carga positiva parcial (δ + ).
Esta alta polaridad del grupo carbonilo se explica sobre la base de la resonancia que involucra estructuras neutras [Fig. 1] y dipolares [Fig. 2].
Las reacciones de adición nucleófila ocurren entre aldehídos y cetonas. Un nucleófilo, Nu- , se aproxima al plano del grupo carbonilo desde un ángulo de unos 75° a lo largo del enlace C = O y se une a un átomo de carbono carbonilo electrofílico. El estado hibridado del átomo de carbono del carbonilo cambia de sp 2 a sp 3 durante este proceso. El par de electrones en el enlace C=O cambia a oxígeno carbonilo, lo que da como resultado la formación de un ion alcrust tetraédrico intermedio. Para producir el producto final, este intermedio tetraédrico se protona. Como resultado, el resultado neto de la adición de Nu – y H + a través del enlace C = O es [consulte la imagen a continuación

Mecanismo de reacción de adición nucleófila
Los aldehídos son más reactivos que las cetonas en los procesos de adición nucleófila por razones tanto estéricas como eléctricas. Debido a que el aldehído tiene solo un sustituyente voluminoso, un nucleófilo puede alcanzar el carbono carbonilo más fácilmente que las cetonas, que tienen dos sustituyentes voluminosos. El carbono carbonílico del aldehído es más electrofílico que el carbono carbonílico de las cetonas. Esto se debe al efecto +I de dos sustituyentes voluminosos en las cetonas que reducen la electrofilia del carbono carbonílico.
El resultado del ataque de los aldehídos se inhibe menos que el producto del ataque de las cetonas, especialmente con un mucleófilo voluminoso (efectos estéricos). Los aldehídos aromáticos son menos reactivos en los procesos de adición nucleofílica que los aldehídos alifáticos. Esto se debe al efecto de resonancia donador de electrones del anillo aromático, que hace que el carbono del carbonilo sea menos electrofílico.
- Adición de cianuro
Los aldehídos y las cetonas agregan cianuro de hidrógeno para dar las cianhidrinas correspondientes. La reacción es reversible y ocurre lentamente cuando se usa cianuro de hidrógeno puro, pero rápidamente cuando se usa una pequeña cantidad de base para generar el nucleófilo CN –
El mecanismo de adición del nucleófilo CN – se da a continuación,
Paso 1: Un nucleófilo fuerte se suma al grupo carbonilo (>C = O) para formar un alcrust intermedio.
Paso 2: el ion alcrust formado se protona con un ácido débil para dar el producto de adición.
[Nota: la formación de cianohidrina es reversible. El orden de reactividad es formaldehído > otros aldehídos > cetonas]
Por ejemplo:

El acetaldehído reacciona con cianuro de hidrógeno para dar cianhidrina de acetal.
- Adición de bisulfato de sodio
Los aldehídos y las cetonas cuando se tratan con solución acuosa saturada de bisulfato de sodio dan productos de adición
Son sólidos cristalinos solubles en agua que son sales de ácido hidroxisulfónico. Al tratarlos con ácidos minerales débiles o álcalis, pueden hidrolizarse fácilmente de nuevo a aldehídos y cetonas. Como resultado, este proceso se usa para separar y purificar aldehídos o cetonas de otras moléculas orgánicas.
- Adición de reactivo de Grignard
Un aldehído o una cetona se someten a la adición nucleófila del reactivo de Grignard en presencia de éter seco para formar un complejo que por hidrólisis ácida da alcohol.
El metanal reacciona con yoduro de metil magnesio en presencia de éter seco para dar un complejo que por hidrólisis ácida da etanol.
Nota: El metanal produce alcoholes primarios que contienen un carbono más que en el reactivo de Grignard.
- Adición de alcoholes
Los aldehídos y las cetonas reaccionan con los alcoholes para formar acetal ramificado y acetal cíclico.
- acetal ramificado
Se agregan dos moléculas de alcohol al grupo carbonilo para formar acetal mediante la eliminación de una molécula de agua.
Paso 1: Adición catalizada por ácido de un alcohol al grupo carbonilo en presencia de cloruro de hidrógeno seco, para formar hemiacetal.
Paso 2: en la segunda mitad del mecanismo, el hemiacetal se convierte en acetal más estable
- acetal cíclico
El acetal es un compuesto de dialcoxi geminal (un éter). Los aldehídos y las cetonas reaccionan con un equivalente de 1,2 o 1,3 -dioles en presencia de cloruro de hidrógeno seco para dar acetal cíclico.
El acetal y los cetales se hidrolizan rápidamente en aldehídos y cetonas, por la acción de ácidos minerales diluidos, incluso a temperatura ambiente.
- Adición de amoníaco y su derivado
La urotropina se forma cuando el formaldehído interactúa con un exceso de amoníaco para formar hexametilentetramina. La urotropina se usa como antiséptico para el tracto urinario, así como para tratar el reumatismo y la gota. También se utiliza en la fabricación de polímeros y productos farmacéuticos. Cuando se nitra, produce ciclonita, un poderoso explosivo.
6HCNO + 4NH 3 ⟶ (CH 2 ) 6 N 4 + 6H 2 O
La hexametilentetramina tiene una estructura similar a una jaula compuesta por tres anillos de seis miembros, cada uno en conformación de silla.

Estructura de hexametilentetramina
El acetaldehído disuelto en éter reacciona con el gas amoníaco para formar acetaldehído amónico sólido. Pierde una molécula de agua para dar una imina que se trimeriza aún más para dar un compuesto heterocíclico.
Cuando la acetona se hierve con amoníaco en un medio ligeramente ácido durante mucho tiempo, se forma diacetona amina. Las reacciones tienen lugar en dos pasos como sigue.
Varios derivados del amoníaco del tipo H 2 N-Z reaccionan con aldehídos o cetonas para formar un producto de adición que pierde una molécula de agua para formar iminas. El proceso es reversible y catalizado por ácido. El oxígeno del carbonilo se protona, lo que hace que el carbono del carbonilo sea más vulnerable al ataque del nucleófilo H 2 NZ. Sin embargo, en medios suficientemente ácidos, el átomo de nitrógeno del derivado de amoníaco H 2 NZ se protona, dando como resultado el ion HI N+-Z, que ya no es un nucleófilo. Como resultado, el proceso se ve favorecido por una baja acidez.
Aquí Z es -R, -Ar, -OH, -NH 2 , -NHC 6 H 5 etc. El grupo C = O se transforma en el grupo C = N – Z. La mayoría de las iminas se pueden hidrolizar de nuevo a aldehídos, cetonas y aminas. Una base de Schiff es una imina sustituida. Debido a que estos derivados de imina son frecuentemente sólidos con altas temperaturas de fusión, se emplean para la caracterización e identificación de aldehídos y cetonas.
Nota: El ácido carboxílico tiene un grupo carbonilo pero no sufre una adición nucleófila como lo hacen el aldehído y la cetona. La carga positiva parcial en el átomo de carbono del carbonilo se reduce como resultado de la resonancia.
Ejemplos de preguntas
Pregunta 1: ¿Qué son los aldehídos y las cetonas? ¿Cómo se clasifican las cetonas?
Responder:
Los aldehídos son los compuestos de carbonilo, en los que el grupo carbonilo está unido con al menos un átomo de -H.
Las cetonas son los primeros productos de oxidación de los alcoholes secundarios. Contienen grupo funcional > C = O.
Clasificación de cetonas
- Cetona simple (grupos alquilo similares)
- Cetona mixta (diferentes grupos alquilo)
Pregunta 2: Explique que los aldehídos y las cetonas experimentan una reacción nucleófila y el ácido carboxílico no.
Responder:
En el grupo carbonilo (C=O)), siendo el oxígeno más electronegativo, los electrones se desplazan ligeramente hacia el átomo de oxígeno. Debido a esto, el átomo de carbono desarrolla una carga positiva parcial (deficiente en electrones)
Por lo tanto, el átomo de carbono en el grupo carbonilo es fácilmente atacado por una reacción de adición nucleófila.
Por otro lado, el ácido carboxílico posee un grupo carbonilo pero, a diferencia del aldehído y la cetona, no sufre una adición nucleófila. Como resultado de la resonancia, se reduce la carga positiva parcial del átomo de carbono del carbonilo.
Pregunta 3: ¿Cuál es la acción del siguiente reactivo sobre el formaldehído?
- HCN
- NaHSO3 _
Responder:
- HCN
Acción del HCN sobre el formaldehído: Cuando el formaldehído reacciona con cianuro de hidrógeno, se obtiene cianhidrina de formaldehído.
- NaHSO3 _
El formaldehído cuando reacciona con bisulfito de sodio da bisulfito de sodio de formaldehído.
Pregunta 4: ¿Por qué el aldehído experimenta una reacción de adición nucleófila más fácilmente que las cetonas?
Responder:
El grupo liberador de electrones (efecto I) de los radicales alquilo unidos al carbono del carbonilo en la cetona hace que el carbono del carbonilo sea menos positivo. Esto reduce la propensión del carbono carbonílico a aceptar el nucleófilo. Como resultado, los aldehídos son más fácilmente nucleofílicos que las cetonas.
Pregunta 5: ¿Cómo preparará hexametilentetramina usando un aldehído, también dibujará su estructura?
Responder:
Usando formaldehído podemos preparar hexametilentetramina
El formaldehído, cuando reacciona con amoníaco (NH 3 ) en solución de éter da hexametilentetramina, es decir, urotropina
Pregunta 6: ¿Cuál es la acción del CH 3 – MgI sobre el acetaldehído, dar reacción?
Responder:
El acetaldehído cuando reacciona con CH 3 – MgI en presencia de éter seco, da Mg – complejo, que por hidrólisis con dil. ácido da iso – alcohol propílico
Pregunta 7: Escriba la estructura del compuesto carbonilo y los derivados de amonio que se combinan para dar la siguiente imina.
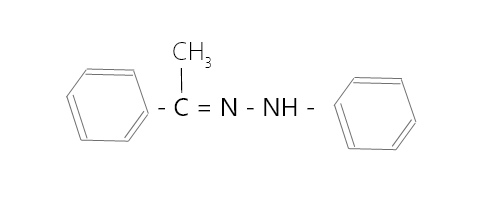
Responder:
El compuesto de carbonilo es,
El derivado de amonio es,
Publicación traducida automáticamente
Artículo escrito por lunaticgemini2510 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA




















