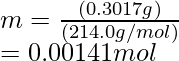La forma más conveniente de describir la concentración de un soluto en una solución particular es la concentración molar . El número de moles de soluto disueltos por litro de solución se conoce como molaridad. Como resultado, M = moles por litro. La cantidad en moles de la solución, que es la concentración molar, será determinada por todos los cálculos de moles.
Una relación molar entre el ácido y la base es siempre el resultado de una ecuación química balanceada. Como resultado, aumenta el número de moles en la base. Al dividir el número de moles por el volumen de la solución, podemos obtener la concentración molar. Todos los valores de moles se utilizan para calcular la concentración molar, que es el volumen de moles en la solución.
Fórmula
La concentración molar de una solución se calcula como la relación entre la cantidad en moles y el volumen de la solución dada. Su fórmula se da de la siguiente manera:
Concentración molar = Cantidad en moles/Volumen de la solución
Problemas de muestra
Pregunta 1. Si 16.35 mL de una solución de AgNO 3 reaccionan con 0.0003017 kg de KIO 3, encuentre su concentración.
Solución:
AgNO 3 + KIO 3 = AgIO 3 + KNO 3
Número de moles en KIO 3 = Masa/Masa molar
Por lo tanto, Número de moles en AgNO 3 = 0.00141 mol
Ahora, Concentración de AgNO 3 = Moles/Volumen
Concentración de AgNO 3 = (0,00141)/(0,01635)
= 0,08624 M
Pregunta 2. ¿Para qué se usa la fórmula de la molaridad?
Solución:
La fórmula de concentración en química se utiliza en una variedad de ramas de estudio. Esta fórmula se usa con frecuencia en cursos de ciencias avanzadas para ayudar a los estudiantes a comprender la cinética de las reacciones químicas. De hecho, la molaridad puede usarse para evaluar la influencia de la expansión térmica en los fluidos. Esta fórmula se puede utilizar para calcular las cantidades de sustancias que reaccionan o la cantidad necesaria para que una reacción produzca un resultado calculado.
Pregunta 3. Encuentra la molaridad de 4 g de sosa cáustica, si estuviera en 200 ml de solución.
Solución:
Masa = 4 g
Volumen = 200ml
Masa molar de sosa cáustica = 23 + 16 + 1 g
= 40 gramos
Molaridad = Masa/Masa molar
= 4g/40g
= 0,1 gramos
Pregunta 4. Se usaron 15 g de sulfato de sodio para hacer una solución. La solución tiene un volumen de 125 ml. Encuentre la molaridad de la solución de sulfato de sodio suministrada.
Solución:
Masa molar de sulfato de sodio = 23 × 2 + 32 + 16 × 4 = 142 g
Número de moles en sulfato de sodio = 15/142 = 0,106
Volumen de la solución = V = 0.125l
Entonces, molaridad = n/V
= 0,106/0,125
= 0,85 M
Pregunta 5. Determinar la concentración molar de hidrrust de sodio para su reacción con ácido clorhídrico.
Solución:
HCl + NaOH → NaCl + H2O
Número de moles en HCl = Número de moles en NaOH = 8,75 × 10 -3 mol.
La cantidad de NaOH presente en moles es
Volumen de solución = 25 × 10 -3 dm 3
M = 8,75 × 10 −3 /25,0 × 10 -3
= 0,350 mol dm- 3
Publicación traducida automáticamente
Artículo escrito por parmaramolaksingh1955 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA