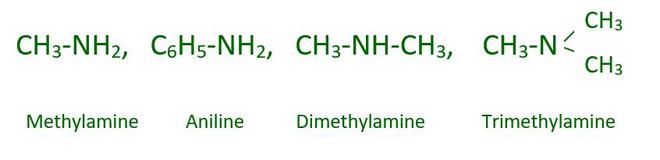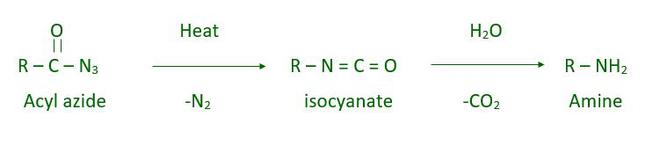Las aminas son compuestos orgánicos formados al sustituir un grupo alquilo o arilo por uno o más átomos de hidrógeno en una molécula de amoníaco (NH 3 ). Se pueden encontrar en la naturaleza en proteínas, vitaminas, alcaloides y hormonas. Los materiales sintéticos incluyen polímeros, tintes y productos farmacéuticos. La presión arterial se eleva usando dos compuestos biológicamente activos, adrenalina y efedrina, los cuales contienen un grupo amino secundario. Benadryl, un conocido fármaco antihistamínico, también contiene un grupo amino terciario. Se utilizan tensioactivos elaborados a partir de sales de amonio cuaternario. Las sales de diazonio se utilizan como productos intermedios en la producción de una amplia gama de compuestos aromáticos, incluidos los colorantes.
Las aminas son derivados del amoníaco formados al sustituir grupos alquilo y/o arilo por uno, dos o los tres átomos de hidrógeno. Las aminas incluyen lo siguiente:
Preparación de Aminas
Existen diferentes métodos para preparar aminas:
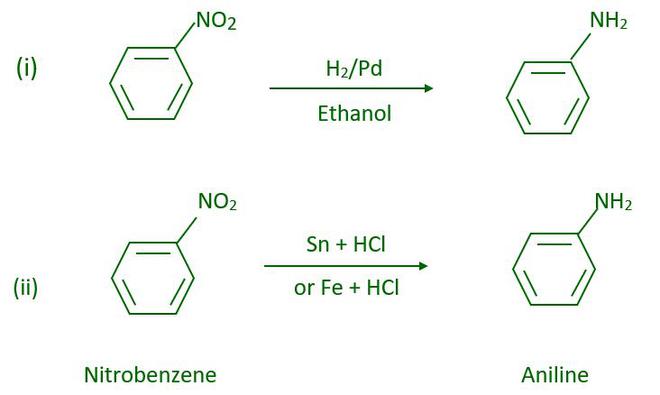
- De la reducción del compuesto nitro
Al pasar gas hidrógeno a través de níquel, paladio o platino finamente divididos, así como por reducción con metales en un medio ácido, los compuestos nitro se reducen a aminas. Los nitroalcanos también se pueden reducir a las correspondientes alcanaminas de la misma manera.
Se prefiere la reducción con chatarra de hierro y ácido clorhídrico porque el FeCl 2 formado durante la reacción se hidroliza, liberando ácido clorhídrico. Como resultado, solo se requiere una traza de ácido clorhídrico para iniciar la reacción.
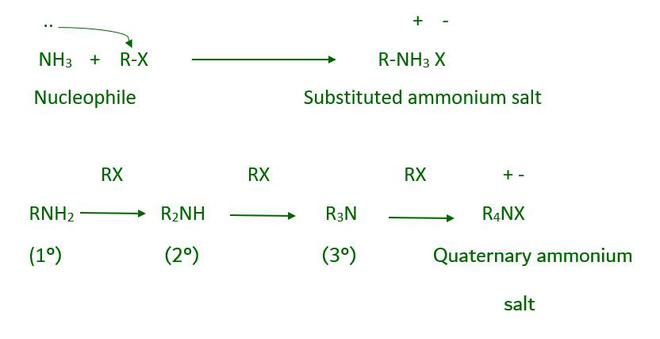
- De amonólisis Halogenuro de alquilo
El enlace entre el carbono-halógeno y los haluros de alquilo o bencilo se puede romper fácilmente mediante una reacción nucleófila. Como resultado, cuando un haluro de alquilo o bencilo reacciona con una solución etanólica de amoníaco, ocurre una reacción de sustitución nucleófila en la cual el átomo de halógeno es reemplazado por un grupo amino (–NH2). La amonólisis es el proceso por el cual una molécula de amoníaco escinde el enlace C-X. La reacción tiene lugar en un tubo sellado a 373 K. La amina primaria resultante es un nucleófilo y puede reaccionar con un haluro de alquilo para formar aminas secundarias y terciarias y, finalmente, sal de amonio cuaternario.
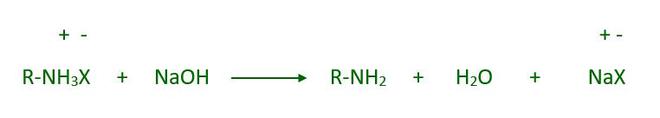
Al tratar la sal de amonio con una base fuerte, se puede obtener la amina libre:
La amonólisis del haluro de alquilo tiene una desventaja durante la reacción: forma una mezcla de aminas primarias, secundarias y terciarias y amonio cuaternario, por lo que para obtener amina primaria, como producto principal, pasamos un gran exceso de amoníaco.
- Por reducción de Nitrilos
Las aminas primarias se forman cuando los nitritos se reducen con hidruro de litio y aluminio (LiAlH4) o se hidrogenan catalíticamente. Esta reacción se utiliza para preparar aminas con un átomo de carbono más que la amina de partida, lo que se conoce como ascenso en serie de aminas.
H2 / Ni
R-CN ————————-> R-CH 2 -NH 2
Na(Hg) /C 2 H 5 OH
Por reducción de amida
Cuando las amidas se reducen con hidruro de litio y aluminio, se forman aminas.
(i) LiAlH4
R-CO-NH2 —————————–> R-CH2-NH2
( ii) H2O
- De Síntesis de ftalimida de Gabriel
La síntesis de Gabriel es un método para producir aminas primarias. Cuando la ftalimida se trata con hidrrust de potasio etanólico, forma una sal de potasio de ftalimida, que cuando se calienta con un haluro de alquilo y luego se hidroliza alcalinamente produce la amina primaria correspondiente. El método de síntesis de ftalimida de Gabriel no produce aminas primarias aromáticas porque los haluros de arilo no experimentan una reacción de sustitución nucleófila con el anión formado por la ftalimida.
- De la reacción de degradación de la bromamida de Hoffmann
Hoffmann desarrolló un método para producir aminas primarias mediante el tratamiento de una amida con bromo en una solución acuosa o etanólica de hidrrust de sodio. Un grupo alquilo o arilo migra del carbono carbonilo de la amida al átomo de nitrógeno durante esta reacción de degradación. La amina así formada tiene un átomo de carbono menos que la amida.
R-CO-NH 2 + Br 2 + 4NaOH —————————–> R-NH 2 + Na 2 CO 3 + 2NaBr + 2H 2 O
(amida) (hidrrust de sodio) (amina)
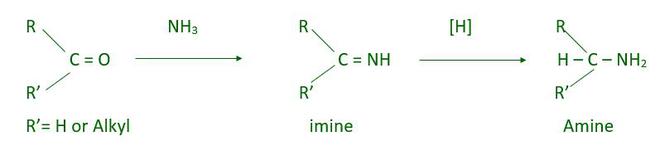
- Animación reductiva de aldehídos y cetonas.
La animación reductora de aldehídos y cetonas produce amina 1°, 2° y 3°. Esta reacción tiene lugar en 2 pasos: el primero es la adición nucleofílica que da imina y el segundo paso es la reducción de imina que produce amina.
- reacción de Curtius
La reacción de Curtius también se llama reordenamiento de Curtius. En esta reacción tiene lugar la descomposición de acil azida que forma isocianato. El isocianato es inestable y por hidrólisis da amina.
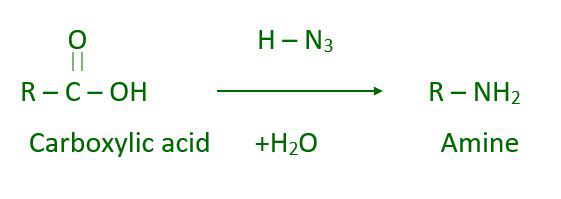
- reacción de Schmidt
En Schmidt, las aminas de reacción se pueden preparar con azida y un ácido carboxílico.
Problemas de muestra
Pregunta 1: ¿Qué son las aminas primarias, secundarias y terciarias ? dar ejemplos.
Responder:
Un átomo de hidrógeno de NH 3 se reemplaza con un grupo alquilo o arilo en la amina primaria o 1°. Dos átomos de hidrógeno de NH 3 se reemplazan con un grupo alquilo o arilo en la amina secundaria o 2°. Tres átomos de hidrógeno de NH 3 se reemplazan con un grupo alquilo o arilo en la amina terciaria.
Ejemplo: CH 3 -NH 2 , CH 3 -NH-CH 3 , CH 3 -N-(CH 3 ) 2
Amina de metilo (1°) Amina de dimetilo (2°) Amina de trimetilo (3°)
Pregunta 2: Escriba el nombre IUPAC de,
- CH 3 –CH 2 –NH 2
- CH 3 –CH 2 –CH 2 –NH 2
- C6H5 – NH2 . _ _ _
Responder:
Los nombres IUPAC son-
- CH 3 –CH 2 –NH 2 – Etanamina
- CH 3 CH 2 –CH 2 –NH 2 – Propan-1-amina
- C 6 H 5 -NH 2 – Bencenamina.
Pregunta 3: ¿Qué sucede cuando se reduce el nitrobenceno? Escribe la ecuación química de la reacción.
Responder:
La reducción de nitrobenceno da anilina como producto final. Ecuacion quimica-
Pregunta 4: ¿Cuál es el método para preparar etilamina en el laboratorio?
Responder:
Se usa la reacción del bromuro de Hofmann En el laboratorio, podemos hacer etilamina usando la reacción del bromuro de Hofmann. Se utilizan soluciones de bromo e hidrrust de potasio para calentar la propionamida.
Pregunta 5: ¿Cuál es más soluble en agua, la amina primaria o las aminas terciarias?
Responder:
Las aminas terciarias son más solubles en agua porque las aminas primarias pueden formar enlaces de hidrógeno con el agua pero las aminas terciarias no pueden, las aminas primarias son menos solubles.
Publicación traducida automáticamente
Artículo escrito por naimishsahu08 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA