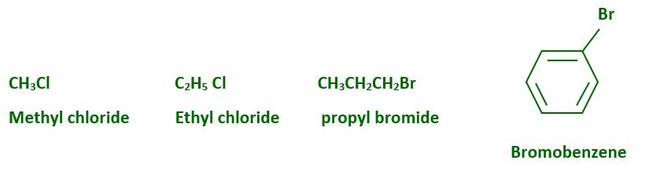
El haluro de alquilo (haloalcano) y el haluro de arilo (haloareno) se forman cuando los átomos de hidrógeno en un hidrocarburo alifático o aromático se reemplazan por átomos de halógeno. Los haloalcanos tienen átomos de halógeno unidos a los átomos de carbono con hibridación sp3 de un grupo alquilo, mientras que los haloarenos tienen átomos de halógeno unidos a los átomos de carbono con hibridación sp2 de un grupo arilo. En la naturaleza existen muchos compuestos orgánicos que contienen halógenos, y algunos de ellos tienen aplicaciones clínicas. Ejemplos de haloalcanos y haloarenos:
Métodos de preparación de Haloalcanos
Existen varios métodos para preparar haloalcanos. Los haloalcanos se pueden preparar a partir de alcohol, a partir de hidrocarburos. Echemos un vistazo a todos los métodos,
- del alcohol
Cuando el alcohol reacciona con ácidos de halógeno concentrados, haluros de fósforo o cloruro de tionilo, el grupo hidroxilo se reemplaza por halógeno. Se prefiere el cloruro de tionilo porque en esta reacción se forma haluro de alquilo junto con los gases SO 2 y HCl. Debido a que los dos productos gaseosos son evitables, la reacción produce haluros de alquilo puros. Se requiere la presencia de un catalizador, ZnCl 2 , para las reacciones de alcoholes primarios y secundarios con HCl. (R – grupo alquilo)
ZnCl2 _
- R-OH + HCl —————–> R-Cl + H2O
- R-OH + PCl 3 —————> R-Cl + POCl 3 + HCl
- R-OH + NaBr + H 2 SO 4 —————–> R-Br + NaHSO 4 + H 2 O
- 3R-OH + PX 3 —————> 3R-X + H 3 PO 3 (X = Cl, Br)
rojo P/X 2
- R-OH —————> RX
X 2 = Br 2 , yo 2
- R-OH + SOCl 2 —————> R-Cl + SO 2 + HCl
El cloruro de alquilo se produce ya sea pasando gas de cloruro de hidrógeno seco a través de una solución de alcohol o calentando una mezcla de ácido halogenado acuoso concentrado en alcohol.
- De Hidrocarburos
- A partir de alcanos por halogenación por radicales libres
Cuando los radicales libres cloran o broman alcanos, se forma una mezcla compleja de mono y polihaloalcanos isoméricos, que es difícil de separar como compuestos puros. Como resultado, el rendimiento de cualquier compuesto individual es extremadamente bajo.
Cl 2 / luz ultravioleta
- CH 3 CH 2 CH 2 CH 3 ——————–> CH 3 CH 2 CH 2 CH 2 Cl + CH 3 CH 2 CHClCH 3
o calor
2. De alquenos
- Adición de haluros de hidrógeno: una reacción con cloruro de hidrógeno, bromuro de hidrógeno o yoduro de hidrógeno convierte un alqueno en el haluro de alquilo correspondiente.
- (CH 3 ) 2 C=C(CH 3 ) 2 + HX —————–> (CH 3 ) 2 C-CX(CH 3 ) 2
El propeno produce dos productos:
- CH 3 CH=CH 2 + HOLA ——————–> CH 3 CH 2 CH 2 I + CH 3 CH CH 3
(Menor Mayor)
- Adición de halógenos
En el laboratorio, agregar bromo en CCl 4 a un alqueno da como resultado la liberación de un color marrón rojizo de bromo, que es un método importante para detectar un doble enlace en una molécula. La reacción da como resultado la formación de vic-dibromuros incoloros.
CCl 4
CH 2 =CH 2 + Br 2 ————————> BrCH 2 -CH 2 Br
(vic-dibromuros)
- Intercambio de halógeno
Los yoduros de alquilo se sintetizan con frecuencia haciendo reaccionar cloruros/bromuros de alquilo con NaI en acetona seca. Esta reacción también se conoce como la reacción de Finkelstein.
RX + NaI ————–> RI + NaX (X = Cl, Br)
Calentar un cloruro/bromuro de alquilo en presencia de un fluoruro metálico para producir fluoruros de alquilo. como AgF (fluoruro de plata), Hg 2 F 2 , CoF 2 o SbF 3 . La reacción de Swarts es el nombre que se le da a esta reacción.
H 3 C-Br + AgF ————–> H 3 C-F + AgBr
Método de Preparación de Haloarenos
Los haloarenos se pueden preparar por varios medios, por ejemplo, se pueden preparar a partir de hidrocarburos, aminas. Echemos un vistazo a estos métodos en detalle,
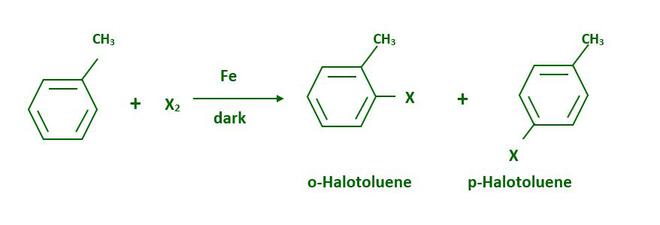
- De hidrocarburos
Los cloruros y bromuros de arilo se pueden sintetizar fácilmente mediante la sustitución electrófila de arenos con cloro o bromo en presencia de catalizadores ácidos de Lewis como el hierro o el cloruro de hierro (III).
Debido a la gran diferencia en los puntos de fusión, los isómeros orto y para se pueden separar fácilmente.
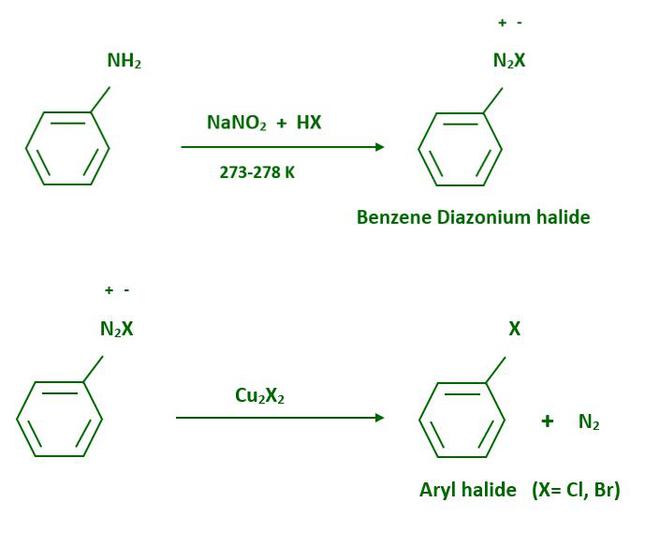
- De aminas
A partir de aminas, se obtienen haloarenos mediante la reacción de Sandmeyer . Cuando una amina aromática se disuelve en la solución de nitrito de sodio, se forma una sal de diazonio. La sal de diazonio recién preparada se mezcla con cloruro cuproso o bromuro cuproso, el grupo diazonio se reemplaza por el grupo –Cl o –Br.
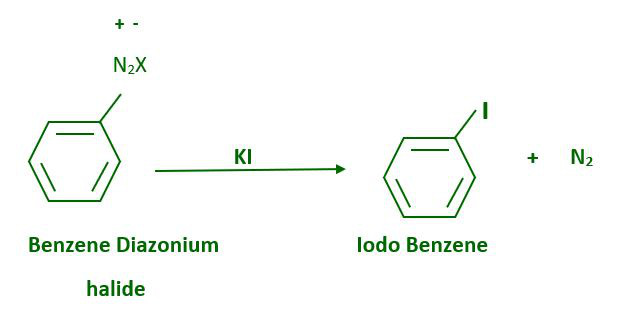
No se requiere la presencia de haluro cuproso para la sustitución del grupo diazonio por yodo, lo que se puede lograr simplemente agitando la sal de diazonio con yoduro de potasio.
Preguntas conceptuales
Pregunta 1: ¿Por qué no se usa ácido sulfúrico en la reacción alcohol-KI?
Responder :
Sabemos que el ácido sulfúrico (H 2 SO 4 ) es un agente oxidante, si lo usamos en una reacción alcohólica de KI, convertirá el KI en el HI correspondiente y oxidará el HI. Es por eso que el ácido sulfúrico no puede usarse en la reacción de alcoholes con KI.
Pregunta 2: Identifique todos los isómeros estructurales de monocloro que probablemente se formen durante la monocloración de radicales libres de (CH3) 2 CHCH 2 CH 3 .
Responder :
Cuando ocurre la monocloración, los siguientes 4 productos producirán:
- (CH 3 ) 2 CHCH 2 CH 2 Cl,
- (CH3 ) 2CHCH ( Cl )CH3 ,
- (CH 3 ) 2 C(Cl)CH 2 CH 3 y
- CH 3 CH (CH 2 Cl) CH 2 CH 3 .
Pregunta 3: Cómo distinguir entre C 2 H 5 Br y C 6 H 5 Br dar prueba de reacción química.
Responder :
Se utiliza NaOH acuoso para calentar ambos. El C 2 H 5 Br produce etanol y NaBr, que al combinarse con AgNO 3 produce un precipitado amarillo de AgBr. Esta prueba no arroja resultados para C 6 H 5 Br.
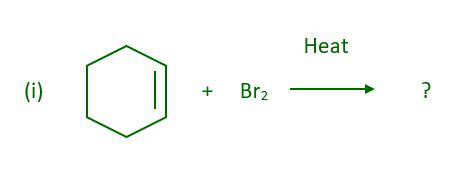
Pregunta 4: ¿Cuál será el producto principal cuando el ciclohexeno reaccione con el bromo en presencia de calor?
Responder:
La reacción anterior da 3-bromociclohexeno.
Pregunta 5: ¿Por qué los haloalcanos se disuelven tan fácilmente en solventes orgánicos?
Responder:
Porque las nuevas fuerzas de atracción formadas entre los haloalcanos y las moléculas de solvente son tan fuertes como las fuerzas de atracción que se rompen.
Publicación traducida automáticamente
Artículo escrito por naimishsahu08 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA