El elemento químico hidrógeno tiene el símbolo H y el número atómico 1. El elemento más ligero es el hidrógeno. En circunstancias normales, el hidrógeno es un gas compuesto de moléculas diatómicas con la fórmula H 2 . Es iNodero, incoloro, no tóxico y extremadamente inflamable. El hidrógeno es el elemento químico más abundante en el universo y representa alrededor del 75% de todas las cosas ordinarias. El Sol, por ejemplo, se compone principalmente de hidrógeno en su estado de plasma. La mayor parte del hidrógeno del planeta se encuentra en forma de moléculas como el agua y las sustancias orgánicas. Cada átomo del isótopo de hidrógeno más común (símbolo 1H) tiene un protón, un electrón y ningún neutrón.
Descubrimiento del perrust de hidrógeno
El miembro más simple de la familia de los perrusts es el perrust de hidrógeno, que fue descubierto originalmente como sustancia química en 1818 por el químico francés JL Thenard. H 2 O 2 es su fórmula molecular. El perrust de hidrógeno se puede encontrar en cantidades muy bajas en el medio ambiente. Las reacciones fotoquímicas en la atmósfera alrededor de la tierra producen perrust de hidrógeno gaseoso. Se utiliza como desinfectante y como agente blanqueador. Es ácido, con un pH de 6 a 7 a 298 grados Fahrenheit.
Estructura del perrust de hidrógeno
- El ion perrust (O 2– 2 ) está presente en el perrust, una molécula química. (O–O) 2– es el ion perrust, que se compone de un solo enlace entre dos átomos de oxígeno. Es un poderoso oxidante.
- El perrust de hidrógeno es una molécula no plana que consta de dos átomos de oxígeno unidos por una única conexión covalente conocida como enlace de perrust.
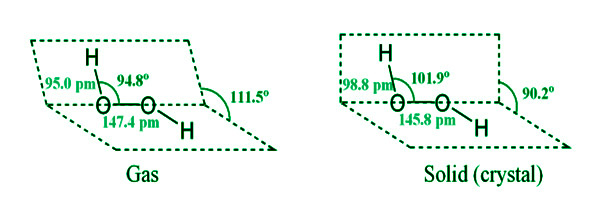
- Está diseñado como un libro. Cada átomo de oxígeno también está conectado a un átomo de hidrógeno por un solo enlace. Debido a que los pares de electrones solitarios se repelen entre sí sobre los átomos de oxígeno, los dos enlaces no se encuentran en el mismo plano. Cuando el perrust de hidrógeno está en estado gaseoso, el ángulo diedro (interplanar) entre los dos planos es de 111,5 ° , pero cuando es cristalino, es de 90,2 ° . El enlace de hidrógeno intramolecular hace que esto suceda.
Los parámetros del enlace de hidrógeno en las fases gaseosa y cristalina son:
Usos del perrust de hidrógeno
El perrust de hidrógeno es un líquido que se puede utilizar de diversas formas. Funciona en todos los medios, incluidos el agua, el aire, las aguas residuales y los suelos. Para mejorar y acelerar los procesos, en ocasiones se combina con otros agentes. Las siguientes son algunas de sus aplicaciones:
- El blanqueo de pulpa y papel consume alrededor de la mitad de la producción mundial de perrust de hidrógeno.
- El cabello humano se decolora con perrust de hidrógeno diluido combinado con amoníaco acuoso.
- Las manchas de sangre nuevas se eliminan con perrust de hidrógeno.
- La solución de H 2 O 2 se utiliza como propulsor para torpedos y submarinos, así como oxidante para combustible de cohetes.
- En acuicultura, el perrust de hidrógeno se utiliza para disminuir la mortalidad causada por diferentes microorganismos.
- Se puede utilizar para esterilizar cepillos cosméticos y desinfectar cepillos de dientes.
- El perrust de hidrógeno es un antiséptico suave que se puede usar para pequeños cortes, rasguños y quemaduras para prevenir infecciones.
- También se puede utilizar como enjuague bucal para eliminar la mucosidad y aliviar molestias bucales menores.
- Ayuda en el tratamiento de infecciones fúngicas en plantas y en la limpieza de estanques infestados de algas.
- Se utiliza en el sector textil como anticloro para eliminar el exceso de cloro después del blanqueo.
- Se utiliza ampliamente en la producción de productos químicos inorgánicos como el perborato y el percarbonato de sodio, que son componentes importantes de los detergentes de alta calidad.
- Se utiliza para restaurar el color de las pinturas con plomo que se han oscurecido como resultado del efecto del H 2 S en el aire sobre las pinturas con plomo.
Propiedades del Perrust de Hidrógeno
Las siguientes son las propiedades físicas y químicas del perrust de hidrógeno:
Propiedades físicas del perrust de hidrógeno
- En su estado anhidro, el perrust de hidrógeno es de color azul pálido. Debido al enlace H–, es un líquido espeso y almibarado iNodero.
- Tiene un sabor amargo que provoca ampollas en la piel.
- Es soluble en agua, alcohol y éter.
- El perrust de hidrógeno es más viscoso y más denso (1,44 g/cm 3 ) que el agua. Esto se debe al hecho de que las moléculas de H 2 O 2 tienen enlaces H– más fuertes que las moléculas de H 2 O.
- Tiene una temperatura de ebullición de 150 grados centígrados y un punto de congelación de –0,89 grados centígrados. El punto de ebullición del perrust de hidrógeno aumenta aún más porque los enlaces de hidrógeno intermoleculares son más fuertes que los del agua.
- El perrust de hidrógeno tiene un momento dipolar un poco más alto (2.1D) que el agua (1.84D).
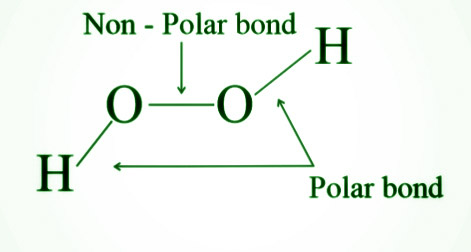
- El perrust de hidrógeno tiene enlaces tanto polares como no polares y es diamagnético.
Propiedades químicas del perrust de hidrógeno
Por su estructura molecular, el H 2 O 2 es un material único. Se compone de átomos de oxígeno en el estado de oxidación de -1, a diferencia de los estados de oxidación de 0 o -2 en muchos otros compuestos. Esto indica que, dependiendo del pH de su solución, este químico puede actuar tanto como agente oxidante como reductor.
- Descomposición
- Descomposición por exposición a la luz: La exposición a la luz también descompone el H 2 O 2 . Como resultado, se mantiene en recipientes de vidrio o plástico revestidos de cera con estabilizadores como la urea.
- Auto-oxidación y autorreducción: El perrust de hidrógeno en su forma más pura es un líquido altamente inestable. Cuando se deja fuera durante mucho tiempo o se calienta, se descompone en agua y oxígeno.
La presencia de metales como platino, oro, rusts metálicos (MnO 2 ) o iones metálicos específicos como los iones Fe 2+ acelera el proceso de descomposición. Su descomposición se ve favorecida incluso por una superficie rugosa.
- Naturaleza ácida
- El H 2 O 2 es un ácido débil ya que se torna rojo tornasol azul. El tornasol no se ve afectado por su solución acuosa. El H 2 O 2 es ligeramente más fuerte que el H 2 O porque su constante de disociación (1,55 × 10 -12 a 293 K) es ligeramente superior a la del H 2 O (1,0 × 10 -14 ).
- Las reacciones de neutralización del perrust de hidrógeno con hidrrusts y carbonatos demuestran su carácter ácido. Por ejemplo , Ba(OH) 2 +H 2 O 2 →BaO 2 +2H 2 O
- Dado que el H 2 O 2 comprende dos átomos de H ionizables, genera dos tipos de sales: hidroperrusts (sales ácidas) y perrusts (perrusts) (sales normales).
- Reducir la propiedad-
El perrust de hidrógeno actúa como agente reductor tanto en medios ácidos como alcalinos cuando están presentes agentes oxidantes potentes. La combinación de H 2 O 2 y el oxígeno naciente [O] generado por el agente oxidante fuerte produce oxígeno molecular en todos estos procesos.
H 2 O 2 + [O] (De agente oxidante) → H 2 O + O 2
- En medio ácido: El perrust de hidrógeno pierde electrones y se oxida a O 2 en un medio ácido.
H 2 O 2 (OS=–1)→2H + +O 2 (OS=0)+2e – [Oxidación]
Por ejemplo,
1) H 2 O 2 convierte una solución rosada de permanganato de potasio acidificado en una solución incolora.
2KMnO4 + 3H2SO4 + 5H2O2 → K2SO4 + 2MnSO4 + 8H2O + 5O2 _ _ _ _ _ _ _
2) En presencia de ácido sulfúrico diluido, convierte el dirust de manganeso en sulfato de manganeso.
MnO 2 (aq)+2H + (aq)+H 2 O 2 →Mn 2 +(aq)+2H 2 O(l)+O 2 (g)
- En medio alcalino: El perrust de hidrógeno se convierte en O 2 en un medio alcalino.
H 2 O 2 +2OH – →2H 2 O+O 2 +2e
Por ejemplo,
1) Las sales férricas se convierten en sales ferrosas.
2Fe 3+ (aq)+H 2 O 2 (aq)+2OH – (aq)→2Fe 2+ (aq)+O 2 (g)+2H 2 O(l)
2) En los medios básicos, convierte el yodo en iones de yoduro.
I 2 (s)+H 2 O 2 (aq)+2OH – (aq)→2I – (aq)+2H 2 O(l)+O 2 (g)
- Propiedad oxidante-
El H 2 O 2 es un poderoso agente oxidante porque toma electrones fácilmente y se reduce tanto en ambientes alcalinos como ácidos.
- En medio ácido: En presencia de un medio ácido, el H 2 O 2 puede recibir electrones y comportarse como un agente oxidante. El H 2 O 2 se descompone en H 2 O.
H 2 O 2 +2H + +2e – →2H 2 O( E o =+1.77V)
Por ejemplo,
1) El sulfato ferroso acidificado se convierte en sulfato férrico.
2Fe 2+ (ac)+H 2 O 2 (ac)+2H + (ac)→2Fe 3+ (ac)+2H 2 O(l)
2) Extrae el yodo de una solución de yoduro de potasio que ha sido acidificada.
2I – (aq)+H 2 O 2 (aq)+2H + (aq)→I 2 (s)+2H 2 O(l)
- En medio alcalino: En medio alcalino, el perrust de hidrógeno puede tomar electrones y operar como agente oxidante.
H 2 O 2 +OH – +2e – →3OH –
Por ejemplo,
1) Cuando el perrust de hidrógeno oxida las sales de manganeso a dirust de manganeso, se produce un precipitado parduzco.
Mn 2 +(aq)+H 2 O 2 (aq)+2OH – (aq)→MnO 2 (s)+2H 2 O(l)
2) Cuando el sulfato de cromo se oxida con perrust de hidrógeno en un medio alcalino, el color verde oscuro cambia a cromato de sodio amarillo.
Cr 2 (SO 4 ) 3 +3H 2 O 2 +10NaOH→2Na 2 CrO 4 +3Na 2 SO 4 +8H 2 O
- En medio neutro: En un medio neutro, el perrust de hidrógeno oxida una amplia gama de sustancias. Por ejemplo,
1) Oxida los sulfitos a sulfatos.
SO 2– 3 +H 2 O 2 →SO 2– 4 +H 2 O
2) Convierte los nitritos en nitratos oxidándolos.
NO – 2 +H 2 O 2 →NO –3 + H 2 O
Preparación de perrust de hidrógeno
Preparación de laboratorio
- A partir de perrust de sodio (Proceso de Merck): El perrust de sodio se introduce en pequeñas cantidades en una solución débil de ácido sulfúrico (20%) rodeada de hielo y agitada constantemente en este procedimiento. Cuando la solución se enfría más, se forman cristales de Na 2 SO 4 . forma 10H 2 O, que se puede filtrar. La solución es una solución acuosa de perrust de hidrógeno al 30 por ciento.
Na 2 O 2 + H 2 SO 4 → Na 2 SO 4 + H 2 O 2
- De perrust de bario: Una pasta de perrust de bario hidratado (BaO 2 .8H 2 O) hecha en agua helada se trata con una solución de ácido sulfúrico helada al 20%. La filtración se utiliza para eliminar el precipitado de BaSO 4 , que es de color blanco. Aproximadamente el 5% de H 2 O 2 permanece en la solución.
BaO 2 ⋅8H 2 O+H 2 SO 4 →BaSO 4 (ppt blanco)+H 2 O 2 +8H 2 O
Este método es ineficiente porque el sulfato de bario genera una capa protectora alrededor del H 2 O 2 que impide que continúe la reacción química. Los iones Ba 2+ en la solución descomponen lentamente el perrust de hidrógeno. Como resultado, la solución no se puede almacenar durante un período de tiempo prolongado. Para probar esto se utiliza ácido fosfórico, en lugar de ácido sulfúrico. El fosfato de bario que se forma se precipita por completo y no hay peligro de descomposición del perrust de hidrógeno en ausencia de iones Ba 2+ .
3BaO 2 ⋅8H 2 O+2H 3 PO 4 →Ba 3 (PO 4 ) 2 (ppt)+24H 2 O+3H 2 O 2
Preparación Industrial
- Por electrólisis de una solución de ácido sulfúrico: En una celda se electroliza una solución de ácido sulfúrico al 50 %. El ácido peroxodisulfúrico se genera en el áNode y, como resultado, se libera hidrógeno en el cátodo.
H 2 SO 4 → H SO – 4 + H +
En el áNode: HSO – 4 →H 2 S 2 O 8 (perrust de ácido sulfúrico) +2e –
En el cátodo: 2H + +2e – →H 2
El perrust de ácido sulfúrico de la celda se elimina y se descompone con agua para producir perrust de hidrógeno.
H 2 S 2 O 8 +2H 2 O→2H 2 SO 4 +H 2 O 2
El ácido sulfúrico con un alto punto de ebullición no se destila, aunque sí lo hace el perrust de hidrógeno. Cuando se electroliza una mezcla de sulfato de amonio y ácido sulfúrico en proporciones iguales, se puede aumentar la producción de perrust de hidrógeno.
El perrust de hidrógeno se obtiene destilando con agua el sulfato de perrust de amonio producido en el áNode.
(NH 4 )2S 2 O 8 +2H 2 O→2NH 4 HSO 4 (hidrogenosulfato de amonio)+H 2 O 2
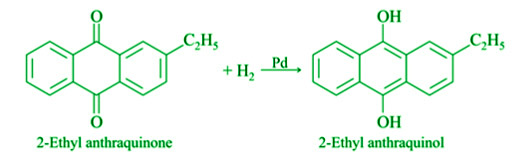
- De 2-etil antraquinona: El gas hidrógeno se transporta a través de 2-etil antraquinona disuelta en benceno en presencia de un catalizador de paladio. Se descompone en 2etil antraquinol. Luego se hace circular por el aire una mezcla de 2etil antraquinol, benceno y ciclohexanol. El perrust de hidrógeno se crea cuando se oxida de nuevo a 2etil antraquinona.
- Por oxidación de alcohol isopropílico: Cuando se combina una pequeña cantidad de perrust de hidrógeno con alcohol isopropílico, funciona como iniciador. Alrededor de 340 K, y con un poco de presión, se transfiere oxígeno a través de la solución. La acetona y el perrust de hidrógeno se producen como resultado de la reacción de oxidación.
CH 3 CHOHCH 3 (Alcohol isopropílico)+O 2 →CH 3 COCH 3 (Acetona)+H 2 O 2
Ejemplos de preguntas
Pregunta 1: ¿Es seguro usar perrust de hidrógeno?
Responder:
La mayoría de las personas están seguras cuando utilizan el perrust de hidrógeno correctamente. Sin embargo, si una persona toma la sustancia con demasiada frecuencia o en dosis altas, puede ser peligrosa. Para evitar la irritación, es fundamental usar una concentración de no más del 3% y usarlo con moderación. Debido a que existe el riesgo de tragar perrust de hidrógeno, los niños deben evitar manipularlo.
Pregunta 2: ¿El perrust de hidrógeno mata los gérmenes?
Responder:
Cuando se permite que el perrust de hidrógeno permanezca en las superficies durante al menos 10 minutos a temperatura ambiente, es más efectivo. El perrust de hidrógeno puede desactivar una amplia gama de microorganismos, incluidos virus, bacterias, hongos y esporas, y actúa como desinfectante al eliminar los componentes críticos de las células germinales.
El perrust de hidrógeno es una buena opción para usar en superficies inanimadas como metal, vidrio y plástico cuando se trata de reducir los gérmenes en su hogar y contener la propagación de Covid19. Según los Centros para el Control y la Prevención de Enfermedades (CDC) (CDC).
Pregunta 3: ¿El perrust de hidrógeno es más fuerte que la lejía?
Responder:
Cuando hablamos de lejía, nos referimos a la lejía con cloro, que se compone de hipoclorito de sodio. La lejía, como el perrust de hidrógeno, produce oxígeno naciente, que es un agente blanqueador. A pesar de que la lejía es más poderosa que el perrust de hidrógeno, es una toxina muy peligrosa. Requiere una dilución cuidadosa para un uso seguro, y solo se debe usar agua fría. El perrust de hidrógeno, por otro lado, tiene un menor impacto ambiental y es efectivo en el tratamiento de aguas residuales y sustancias desinfectantes.
Pregunta 4: ¿El enjuague con perrust blanqueará los dientes?
Responder:
Hacer gárgaras con perrust de hidrógeno puede ayudar a aliviar el dolor de garganta, desinfectar la boca y blanquear los dientes. Sin embargo, debe diluirse. Si se ingiere, una mayor concentración de perrust de hidrógeno causa daño a los órganos internos y sangrado excesivo. Mientras se enjuaga con la solución diluida, evite la ingestión. Sin embargo, para desarrollar dientes más blancos con solo hacer gárgaras o enjuagues, deberá hacerlo durante mucho tiempo.
Pregunta 5: ¿Cuál es el proceso de Merck?
Responder:
En esta técnica, el perrust de sodio se agrega en cantidades mínimas a una solución débil de ácido sulfúrico (20 %) cubierta por hielo y agitada regularmente. Cristales de Na 2 SO 4 . 10H 2 O se producen a medida que la solución se enfría más y se pueden filtrar. Se utiliza una solución acuosa de perrust de hidrógeno al 30 por ciento.
Na 2 O 2 + H 2 SO 4 → Na 2 SO 4 + H 2 O 2
Pregunta 6: ¿Cuál es la diferencia entre el agua y el perrust de hidrógeno?
Responder:
El agua y el perrust de hidrógeno tienen diferentes propiedades físicas según la extensión de los enlaces de hidrógeno. El perrust tiene una mayor fuerza de enlace de hidrógeno que el agua porque tiene un átomo de oxígeno más que el agua, lo que permite una mayor formación de enlaces de hidrógeno.
Debido a la tensión en el enlace O-O en el perrust de hidrógeno, las características químicas del agua y del perrust de hidrógeno difieren. Los pares solitarios en dos átomos de oxígeno en el perrust de hidrógeno causan mucha tensión, lo que debilita el enlace O-O y permite que se descomponga rápidamente en agua y oxígeno. Con la excepción de la molécula de agua, este no es el caso. No tiene ninguna tensión de enlace O-O.
Publicación traducida automáticamente
Artículo escrito por amanarora3dec y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA