El sodio es un metal blando, es el undécimo elemento de la tabla periódica. Está representado por el símbolo Na y el número atómico del sodio es 11. Pertenece a la familia de elementos del bloque s en la tabla periódica.
El sodio es el sexto elemento más abundante. Su cantidad en la corteza terrestre es de casi el 2,8% en masa. El sodio se presenta en formas compuestas, una de las fuentes más destacadas de sodio es el cloruro de sodio, también conocido como sal común, que está disponible en el agua de mar en grandes cantidades.
Es uno de los metales alcalinos. El sodio es uno de los elementos más abundantes que se disuelven en el agua de mar. El sodio es un ingrediente necesario para los seres humanos, pero si se consume en exceso puede dañar los riñones y también puede causar problemas de presión arterial alta.
Las propiedades del sodio son:
- Su apariencia es de color blanco plateado.
- El sodio tiene un punto de fusión bajo de 97,8 o Celsius .
- Es un elemento extremadamente reactivo y por eso nunca se encuentra en estado libre.
- El sodio es capaz de conducir el calor y la electricidad.
- El sodio es un elemento muy ligero incluso más ligero que el agua.
- A temperatura ambiente, el sodio se puede cortar fácilmente con un cuchillo.
- Debido a su naturaleza reactiva, se almacena bajo aceite mineral anhidro.
- A bajas temperaturas, el sodio es frágil por naturaleza.
Los usos del sodio son:
- El sodio es utilizado por todos los seres humanos en forma de cloruro de sodio, también conocido como sal común.
- Se utiliza para fabricar lámparas de vapor de sodio.
- También se utiliza en la síntesis de polímeros como el nailon.
- Uno de los usos más comunes del sodio es en la fabricación de aditivos para gasolina.
- El sodio también se utiliza en la formación de cianuro de sodio.
- Muchos tintes y perfumes también se fabrican con cierta cantidad de sodio.
- El sodio también se utiliza para la purificación de hidrocarburos.
Algunos compuestos importantes de sodio
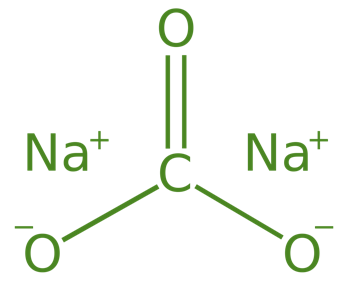
Carbonato de sodio (Na 2 CO 3 .10H 2 O)
El Carbonato de Sodio es también conocido como Soda de Lavado , su fórmula es Na 2 CO 3 .10H 2 O y su nombre químico es carbonato de sodio decahidratado. El carbonato de sodio se prepara principalmente mediante el proceso Solvay .
El proceso Solvay es un proceso de 4 pasos.
- Comienza con la reacción de amoníaco, agua y dirust de carbono que da como resultado la formación de carbonato de amonio.
2NH 3 + H 2 O + CO 2 → (NH 4 ) 2 CO 3
- Ahora, el carbonato de amonio se vuelve a hacer reaccionar con agua y dirust de carbono para formar hidrogenocarbonato de amonio.
(NH 4 ) 2 CO 3 + H 2 O + CO 2 → 2NH 4 HCO 3
- Ahora, el hidrogenocarbonato de amonio se mezcla con cloruro de sodio para obtener cloruro de amonio e hidrogenocarbonato de sodio.
NH 4 HCO 3 + NaCl → NH 4 Cl + NaHCO 3
- El último paso es calentar cristales de hidrogenocarbonato de sodio para obtener carbonato de sodio.
2NaHCO3 → Na2CO3 + CO2 + H2O _ _ _ _
Propiedades del Carbonato de Sodio
- Se presenta en forma de un sólido cristalino blanco.
- Se llama decahidrato porque tiene 10H 2 O adherido que puede eliminarse calentándolo.
- El carbonato de sodio se puede disolver fácilmente en agua.
- Si el carbonato de sodio se calienta por encima de los 100 ° C, cambiará a un polvo de color blanco conocido como ceniza de soda.
- Es de naturaleza alcalina.
Usos del carbonato de sodio
- El carbonato de sodio se utiliza para ablandar el agua dura.
- Se utiliza en las industrias de jabones y pinturas para la fabricación de jabones, detergentes y pinturas.
- También se utiliza en la industria textil y del vidrio.
- También se utiliza en el proceso de fabricación del vidrio.
- La industria del papel también utiliza carbonato de sodio en el proceso de fabricación de papel.
Cloruro de sodio
El cloruro de sodio también se conoce como sal común, su fórmula es NaCl . Se encuentra principalmente en el agua de mar. Se puede obtener fácilmente del agua de mar por el proceso de evaporación.
La evaporación solar es el proceso que se utiliza para producir comercialmente cloruro de sodio a partir del agua de mar. Cada año, la India produce alrededor de cincuenta lakh de toneladas de cloruro de sodio para múltiples propósitos.
El cloruro de sodio obtenido tras la evaporación del agua de mar no es puro y se utilizan diferentes procesos para hacerlo puro. El cloruro de sodio también se encuentra en formas rocosas debajo de la superficie de la tierra que se forma por un proceso de descomposición que tomó millones de años.
Propiedades del Cloruro de Sodio
- El cloruro de sodio se encuentra en forma de cristales incoloros.
- Es fácilmente soluble en agua.
- Tiene un alto punto de fusión de 801 ο Celsius.
- La solución de cloruro de sodio puede conducir fácilmente la electricidad.
- El cloruro de sodio tiene una estructura cúbica estrechamente empaquetada.
- El cloruro de sodio no tiene olor significa que es iNodero pero tiene un sabor salado.
- El cloruro de sodio es insoluble en aceite.
Usos del cloruro de sodio
- Se utiliza como ingrediente para la elaboración de alimentos.
- También se utiliza como conservante por ejemplo en la conservación de la carne.
- Se utiliza en la preparación de soda cáustica y soda de lavado.
- El sodio líquido se utiliza como refrigerante en los reactores nucleares.
- Utilizado por el cuerpo para transmitir señales nerviosas.
- Se utiliza para eliminar manchas de grasa.
- También se usa en muchas gotas para los ojos para tratar el enrojecimiento de los ojos y algunos otros problemas oculares comunes.
- En caso de presión arterial baja, se administra cloruro de sodio con agua para mantener la presión arterial.
Hidrrust de sodio
El hidrrust de sodio también se conoce como soda cáustica y su fórmula es NaOH . Se prepara mediante electrólisis de cloruro de sodio que se realiza en un tipo especial de celda llamada celda Castner-Kellner. Tome mercurio como cátodo y carbono rodado como áNode, la solución de cloruro de sodio ahora está electrolizada. La formación de amalgama de sodio tiene lugar en el cátodo y el cloro gaseoso se libera en el áNode. El proceso se puede entender fácilmente por las siguientes reacciones en el áNode y el cátodo.
En Cátodo: Na + + e – → Amalgama de sodio
En el áNode: Cl – → 1/2Cl 2 + e –
Ahora la amalgama de sodio se trata con agua para obtener hidrrust de sodio o soda cáustica junto con gas hidrógeno y mercurio.
2Na-Amalgama + 2H 2 O → 2NaOH + 2Hg + H 2
Propiedades del Hidrrust de Sodio
- Tiene un alto punto de ebullición de 1390 o Celsius.
- Se puede disolver fácilmente en agua o alcohol.
- Su aspecto es sólido blanco.
- El hidrrust de sodio es insoluble en éter.
- El punto de fusión del hidrrust de sodio es de 318,4 o Celsius .
- Es de naturaleza tóxica.
Usos del hidrrust de sodio
- Se utiliza principalmente en el proceso de fabricación de jabón.
- Se puede utilizar para limpiar desagües en su forma concentrada.
- Se utiliza para refinar el petróleo en la industria del petróleo.
- El hidrrust de sodio juega un papel importante en el proceso Bayer que se utiliza para producir aluminio.
- Se puede utilizar para la extracción de zinc y chapado de estaño.
Ejemplos de preguntas
Pregunta 1: ¿Cuál es la naturaleza del hidrrust de sodio?
Responder:
El hidrrust de sodio es de naturaleza básica ya que libera iones de hidrrust en el agua. La naturaleza básica del hidrrust de sodio se puede probar haciéndolo reaccionar con un ácido, digamos HCl, porque cuando el ácido y las bases reaccionan forman sal y agua.
NaOH + HCl → NaCl + H2O
Ahora está claro que el NaOH es de naturaleza básica.
Pregunta 2: ¿Cómo se realiza el deshielo de carreteras y puentes resbaladizos con NaCl?
Responder:
El NaCl o sal común se utiliza para descongelar carreteras resbaladizas, ya que el NaCl puede disminuir el punto de congelación del agua, por lo que se dificultará el proceso de formación de hielo, pero simplemente la sal no puede hacer mucho, el agua también debe estar presente, por lo tanto, la solución salina es También conocido como salmuera, se necesita para descongelar caminos resbaladizos.
Pregunta 3: ¿Cómo se puede recuperar el NH 3 utilizado en el proceso Solvay para hacer carbonato de sodio?
Responder:
El NH 3 se puede recuperar tratando el NH 4 Cl (que se forma en el tercer paso) con hidrrust de calcio.
2NH4Cl + Ca ( OH) 2 → 2NH3 + CaCl2 + H2O
Pregunta 4: ¿Cómo el bicarbonato de sodio hace que las tortas y pasteles sean suaves y esponjosos?
Responder:
El bicarbonato de sodio, también conocido como carbonato de hidrógeno y sodio (NaHCO 3 ), se usa principalmente para hacer tortas y pasteles esponjosos y suaves. Los hace livianos ya que libera dirust de carbono para hacer burbujas cuando se calienta.
Pregunta 5: ¿Qué importancia tiene el sodio desde el punto de vista biológico?
Responder:
Los iones de sodio están presentes en la superficie de las células, lo que ayuda a regular el agua y otros compuestos de azúcar en las células, los iones de sodio también ayudan en la transmisión de señales nerviosas a diferentes partes del cuerpo.
Publicación traducida automáticamente
Artículo escrito por lastbitcoder y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA