Varios estados, como plasma, condensados de Bose-Einstein, condensados fermiónicos y plasma de quarks-gluones, son posibles independientemente de los tiempos comunes de sólido, líquido y gas; por ejemplo, el agua existe como hielo, agua líquida y vapor de agua. – pero también son posibles varios estados, como plasma, condensados de Bose-Einstein, condensados fermiónicos y plasma de quarks-gluones. Aparte de eso, se divide en sustancias puras y mezclas.
Enlace químico
El enlace químico es el proceso de unir dos o más átomos mediante la redistribución de electrones, lo que da como resultado que cada átomo alcance un estado electrónico estable.
Para lograr la seguridad, cada uno de los átomos completa su duplete u octeto obteniendo el arreglo electrónico de gas tolerable más cercano. Por lo general, se realiza mediante la formación de conexiones compuestas entre partículas.
De tres maneras, una partícula puede formar enlaces químicos:
- Al menos un electrón se pierde en otro átomo.
- Obtener al menos un electrón de un átomo diferente.
- Transfiriendo un electrón a otro átomo.
Tipos de enlaces químicos
Los enlaces químicos se clasifican en cuatro grupos:
- Enlace iónico o electrovalente
- Enlace covalente
- Enlace de hidrógeno
- enlace covalente polar
Enlace iónico
La regla del octeto establece que un átomo es más estable cuando su capa de valencia tiene ocho electrones. Los átomos en estado sólido pierden, adquieren o comparten electrones en su capa de valencia para lograr la estabilidad. Un catión se forma cuando un átomo pierde uno o más electrones de valencia para convertirse en un ion con carga positiva, mientras que un anión se forma cuando un átomo recibe electrones y se convierte en un ion con carga negativa.
Una fuerza eléctrica de atracción conocida como enlace iónico surge cuando los electrones se transfieren por completo del catión con carga positiva al anión con carga negativa.
La regla del octeto se cumple cuando se intercambian electrones de valencia, lo que permite que los iones alcancen configuraciones electrónicas de gases nobles vecinos. Una carga positiva en superíndice (+) a la derecha del átomo denota un catión. Una carga negativa en superíndice (–) a la derecha del átomo representa un anión.
Por ejemplo:
- Cuando un átomo de sodio pierde un electrón, gana un protón más de lo que pierde un electrón, lo que le otorga una carga positiva (+1) en general. El símbolo químico del ion sodio es Na +1 o simplemente Na + .
- Cuando un átomo de cloro recibe un electrón adicional, forma el ion cloruro Cl – . Debido a la regla del octeto, estas especies iónicas son más estables que el átomo.
Formación de un enlace iónico
Un enlace iónico o electrovalente es un enlace químico producido entre dos átomos por la transferencia de uno o más electrones de un elemento electropositivo o metálico a un elemento electronegativo o no metálico. La disposición eléctrica del átomo de sodio es 2,8,1, como sabemos. En su capa más externa, solo posee un electrón. Obtiene la estructura eléctrica del gas inerte del Neón al donar este electrón (2,8).
La disposición eléctrica del átomo de cloro, por otro lado, es 2,8,7. Simplemente necesita un electrón más para completar su octeto y lograr la configuración inerte del Argón (2,8,8).
Para sacar un electrón de su capa más externa y producir el ion de sodio Na + cargado positivamente , el átomo de sodio requiere una cantidad de energía igual a su energía de ionización de aproximadamente 496 kJ/mol. Esto se conoce como un proceso endergónico ya que consume energía. El átomo de cloro, por otro lado, al que le falta un electrón, toma un electrón y libera energía equivalente a su afinidad electrónica, es decir, para producir un ion cloruro, se requieren 349 kJ/mol. El proceso Exorgénico recibe su nombre del hecho de que se libera energía durante el proceso.
Como resultado, los iones con carga opuesta crean fuerzas de atracción electrostáticas, que son poderosas fuerzas de atracción. Estas fuerzas hacen que los iones se acerquen más, lo que da como resultado la formación de un enlace iónico. Las fuerzas electrostáticas son, por lo tanto, la base de una conexión iónica.
Electrovalencia : la cantidad de átomos perdidos o adquiridos por un átomo se conoce como electrovalencia. En NaCl, la electrovalencia del sodio y el cloro es uno. Como resultado, son monovalentes. El calcio proporciona dos electrones de valencia para generar iones de calcio (2,8,8), y el oxígeno obtiene dos electrones para formar iones de rust en la creación de rust de calcio (CaO) (2,8). El calcio y el oxígeno tienen la misma electrovalencia, es decir, son divalentes. Los iones de carga opuesta se forman una vez que se transfieren los electrones. Aquí se ve el desarrollo de un enlace iónico entre los átomos de sodio y flúor.
Condiciones para la formación del enlace iónico
- El número de electrones de valencia presentes en los átomos involucrados en el enlace.
Los átomos con uno, dos o tres electrones de valencia en los grupos I(A), II(A) o 13(A) de la tabla periódica moderna prefieren perder electrones y formar especies con carga positiva conocidas como cationes. Los átomos con 5, 6 o 7 electrones de valencia en los grupos 15, 16 y 17 de la tabla periódica actual, por otro lado, tienen más probabilidades de tomar electrones y formar especies cargadas negativamente conocidas como aniones. Así, el potasio, que está en el grupo I(A) de la tabla periódica actual y tiene un electrón en su capa más externa, es adecuado para crear una conexión iónica con el cloro, que está en el grupo 17 y tiene siete electrones en su capa más externa. Como resultado, el cloruro de potasio se clasifica como una sustancia iónica.
- La baja energía de ionización del metal –
La energía de ionización es la cantidad mínima de energía necesaria para extraer un electrón de la capa más externa de un átomo gaseoso neutro. Considere cómo se forma el ion sodio (Na + ) a partir del átomo de sodio. La energía de ionización del sodio es de alrededor de 500 kJ/mol, que es relativamente baja. Es muy fácil que arroje electrones y se convierta en un ion de sodio. Este ion también puede formar enlaces iónicos con otros aniones como Cl- y Br- . En consecuencia, la creación de enlaces iónicos se ve favorecida cuando la energía de ionización del metal es baja.
- La afinidad electrónica de un no metal:
La energía generada cuando se introduce un electrón en un átomo gaseoso aislado neutro se define como afinidad electrónica. Considere un átomo de flúor, que contiene siete electrones en su órbita más externa. Recibe un electrón sin dudarlo para completar su estructura de octeto. Por mol, esta reacción libera aproximadamente 328 kJ de energía. El ion fluoruro resultante tiene menor energía que el átomo de flúor. Todos sabemos que la energía reducida equivale a más estabilidad. Como resultado, el ion fluoruro es más estable que el flúor. Como resultado, la afinidad electrónica de un metal no mayor favorece la creación de un anión, lo que resulta en una combinación iónica estable.
- La energía reticular del compuesto iónico:
La energía reticular de los compuestos iónicos es una característica clave que influye en su estabilidad. La energía generada cuando se crea un mol gramo de un cristal a partir de sus iones gaseosos se conoce como energía de red. Las fuerzas de atracción electrostática mantienen unidos los iones componentes de un compuesto iónico en cualquier cristal.
- La diferencia de electronegatividad entre dos átomos:
La capacidad de un átomo para atraer electrones hacia sí mismo durante la formación de enlaces se mide por su electronegatividad. Cuando los valores de electronegatividad de los átomos difieren en 1,7 o más, es más probable que se cree una conexión iónica. Considere las moléculas de cloruro de sodio (NaCl) y cloruro de hidrógeno (HCl).
Diferencial de electronegatividad =3,0(Cl)–0,9(Na)=2,1 para NaCl.
En el cloruro de sodio, esto ayuda al establecimiento de una conexión iónica estable.
Diferencial de electronegatividad =3,0(Cl)–2,1(H)=0,9 para HCl.
El enlace entre el hidrógeno y el cloro es covalente debido a la menor diferencia de electronegatividad.
Escritura de la fórmula de un compuesto iónico
Se deben cumplir los dos requisitos siguientes para obtener las fórmulas químicas de los compuestos iónicos:
- Para una estabilidad óptima, el catión y el anión deben obedecer la regla del octeto.
- Los iones deben unirse de tal manera que sus cargas se equilibren y la composición iónica en su conjunto sea neutra.
El número de electrones proporcionados o recibidos está representado por las cargas del anión y del catión. En el enlace iónico, la carga neta del compuesto debe ser cero.
Propiedades de un enlace iónico
- El catión siempre está formado por un metal, mientras que el anión siempre está formado por un no metal.
- A temperatura ambiente, la mayoría de los compuestos iónicos son sólidos cristalinos: los iones componentes del compuesto iónico tienen una fuerte atracción entre sí y están organizados en una estructura tridimensional. Este arreglo le da al cristal su forma geométrica distintiva.
- Los compuestos iónicos tienen puntos de fusión altos porque los iones en ellos se mantienen unidos por fuerzas de atracción extremadamente fuertes. Los compuestos iónicos tienen puntos de fusión relativamente altos, lo que significa que romper el vínculo entre ellos requiere mucha energía térmica.
- Conductividad eléctrica : los compuestos iónicos suelen ser no conductores de electricidad en estado sólido. La fuerza eléctrica de atracción entre los iones se rompe cuando se calientan por encima de su punto de fusión y los iones pueden viajar libremente. La electricidad ahora puede viajar a través de estos iones libres.
- Cuando se introduce en el agua una sustancia química iónica como el cloruro de sodio, el extremo negativo de la molécula de agua atrae los cationes y los extrae del cristal. De manera similar, el extremo positivo de la molécula de agua atrae los aniones, lo que hace que la sustancia química se disuelva en el agua. Por lo tanto, los productos químicos iónicos son solubles en disolventes polares como el agua.
- Los compuestos iónicos son frágiles, se fracturan en fragmentos cuando se aplica una fuerza externa a sus cristales. Esto ocurre porque los iones Na + y Cl – en los cristales de cloruro de sodio están alineados entre sí en una red con una fuerte atracción electrostática.
Cuando se aplica una fuerza externa, la alineación de los iones cambia de tal manera que las cargas similares se acercan. Los iones se separan como resultado de la alta repulsión electrostática. La forma de los cristales se fractura cuando los iones se rompen en pedazos.
Enlace covalente
- En términos simples, un enlace covalente es el intercambio de electrones entre partículas para lograr la configuración de gas honorable de iotas individuales.
- La fuerza eléctrica de la curiosidad mantiene juntas las iotas en un enlace covalente. Este poder está ubicado en medio de los núcleos fuertemente cargados de las partículas reforzadas y los electrones de carga opuesta que comparten.
- El par de electrones de retención son los electrones que unen iotas en un enlace covalente. La organización de un grupo distinto de partículas denominado átomo, el componente más pequeño de un compuesto que tiene el carácter sintético de ese compuesto, es posible gracias a estos pares de electrones.
- En la mesa ocasional, este tipo de tenencia ocurre entre dos partículas de un componente similar o entre componentes que están cerca uno del otro. Esta tenencia se da mayoritariamente entre no metales, aunque también puede observarse entre no metales y metales.
Tipos de enlaces covalentes
El enlace covalente se puede clasificar en las siguientes categorías según el número de pares de electrones compartidos:
- Enlace covalente simple
- Enlace covalente doble
- Enlace covalente triple
- Bonos simples
Cuando solo se comparte un par de electrones entre los dos átomos participantes, se establece un enlace simple. Se utiliza un guión para simbolizarlo (-). Aunque tiene menor densidad y es más débil que los enlaces dobles y triples, este tipo de enlace covalente es el más estable.
Por ejemplo, un átomo de hidrógeno tiene un electrón de valencia y un átomo de cloro tiene siete electrones de valencia en la molécula de HCL. Al compartir un electrón, se establece un enlace simple entre el hidrógeno y el cloro en esta situación.
- Enlaces dobles
Cuando se comparten dos pares de electrones entre los dos átomos participantes, se establece un doble enlace. Se utilizan dos guiones (=) para indicarlo. Los enlaces covalentes dobles son sustancialmente más poderosos que los enlaces covalentes simples, pero también son menos estables.
Ejemplo: un átomo de carbono tiene seis electrones de valencia y dos átomos de oxígeno tienen cuatro electrones de valencia en una molécula de dirust de carbono.
El carbono comparte dos de sus electrones de valencia con un átomo de oxígeno y dos con otro átomo de oxígeno para completar su octeto. El CO2 tiene dos enlaces dobles porque cada átomo de oxígeno comparte sus dos electrones con el carbono.
- Triple enlace
Cuando los dos átomos participantes comparten tres pares de electrones, se establece un enlace triple. Las formas menos estables de enlaces covalentes son los enlaces covalentes triples, que se indican con tres guiones (≡).
Por ejemplo: Cada átomo de nitrógeno con cinco electrones de valencia aporta tres electrones para formar tres pares de electrones para participar en la construcción de una molécula de nitrógeno. Como resultado, los dos átomos de nitrógeno crean un enlace triple.
- Enlace covalente polar: debido a que la electronegatividad de los átomos que se combinan difiere, este tipo de enlace covalente se desarrolla cuando los electrones se comparten de manera desigual. La atracción por los electrones será mayor para los átomos más electronegativos. Entre los átomos, la diferencia electronegativa es mayor que cero pero menor que 2.0. Como resultado, el par de electrones compartidos de ese átomo estará más cerca.
Ejemplo, un potencial eléctrico desigual hace que las moléculas formen enlaces de hidrógeno. El átomo de hidrógeno interactúa con el flúor electronegativo, el hidrógeno o el oxígeno en esta situación.
- Enlace covalente no polar: cuando los átomos comparten la misma cantidad de electrones, se produce este tipo de conexión covalente. La diferencia de electronegatividad entre dos átomos es cero. Ocurre cuando los átomos que se unen tienen una afinidad electrónica comparable (elementos diatómicos).
Ejemplo, las moléculas de gas como el hidrógeno y el nitrógeno incluyen enlaces covalentes no polares.
Polarización de enlaces covalentes: la nube de electrones siempre está más cerca del más electronegativo de los dos átomos que participan en el enlace sigma en los enlaces sigma entre dos átomos distintos. Como resultado, el enlace desarrolla un dipolo permanente y se dice que el enlace covalente está polarizado.
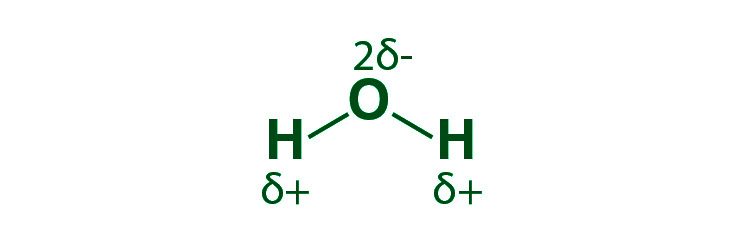
Propiedades del enlace covalente
- Debido a las modestas fuerzas de atracción intermoleculares, los compuestos covalentes tienen puntos de fusión y ebullición bajos. A temperatura ambiente, estos productos químicos existen en los tres estados físicos. Mientras que las interacciones covalentes entre átomos son bastante fuertes, las fuerzas o atracciones intermoleculares entre moléculas/compuestos son comparativamente moderadas. Cuando se aplica una cantidad menor de energía a los enlaces covalentes, las moléculas pueden separarse unas de otras. Como resultado, estos productos químicos son extremadamente volátiles.
- La entalpía de fusión es la cantidad de energía necesaria para fundir un mol de un material sólido a presión constante. La entalpía de vaporización es la cantidad de energía necesaria para vaporizar un mol de líquido a presión constante. Se necesita solo de 1 a 10 veces la cantidad de calor para alterar la fase de un compuesto covalente molecular que para cambiar la fase de una molécula iónica.
- Las fuerzas de atracción intermoleculares débiles caracterizan a los compuestos covalentes, haciendo que adopten la forma de gases, líquidos y sólidos blandos. Hay excepciones, como ocurre con muchas características, particularmente cuando los compuestos moleculares adoptan formas cristalinas.
- La mayoría de los compuestos combustibles están formados por átomos de hidrógeno y carbono. En presencia de oxígeno, estos productos químicos pueden sufrir fácilmente procesos de combustión, produciendo dirust de carbono y agua. Debido a que el carbono y el hidrógeno tienen electronegatividades similares, se encuentran juntos en muchos compuestos moleculares.
- En una solución acuosa, los iones son necesarios para el paso de la electricidad. Cuando los químicos moleculares se mezclan con agua, se disuelven en moléculas en lugar de iones. Debido a que no hay iones móviles libres para conducir la electricidad, cuando se disuelven en agua, normalmente no conducen la electricidad de manera muy efectiva.
- Un disolvente polar, como el agua, disuelve eficazmente los compuestos covalentes polares. El azúcar y el etanol son dos ejemplos de moléculas moleculares que se disuelven fácilmente en agua. Los compuestos covalentes no polares, por otro lado, no se disuelven fácilmente en agua, como agua y aceite. Estas moléculas no pueden ser hidratadas por el agua.
- Las fuerzas de atracción intermoleculares débiles mantienen unidos tanto los enlaces covalentes como las moléculas orgánicas en los disolventes orgánicos. Las moléculas covalentes en los compuestos covalentes son fácilmente miscibles con las moléculas orgánicas en los solventes orgánicos porque tienen el mismo tipo de fuerzas de atracción intermoleculares débiles. Como resultado, la mayoría de los compuestos covalentes son solubles en solventes orgánicos.
- La teoría de Lewis también tiene en cuenta la longitud del enlace; cuanto más fuerte sea la conexión y más electrones se compartan, más corta será la longitud del enlace.
Diferencia entre enlace covalente e iónico.
|
Parámetros |
Enlace covalente |
Enlace iónico |
| ¿Qué es? | Es un tipo de enlace químico entre dos átomos no metálicos que se caracteriza por compartir pares de electrones entre átomos, así como otras conexiones covalentes. | Es una especie de conexión generada por la fuerte fuerza de atracción electrostática entre iones de carga opuesta en una molécula química, también conocida como enlace electrovalente. |
| Ocurre entre | Dos no metales o un no metal y un metaloide | Un metal y un no metal |
| Naturaleza de las partículas componentes | Está formado por moléculas discretas eléctricamente neutras. | Los cationes y los aniones son partículas con carga opuesta que forman compuestos iónicos. |
| Estado a temperatura ambiente | Gases, líquidos o sólidos de bajo punto de fusión | Sólidos cristalinos |
| Polaridad | Bajo | Alto |
| Solubilidad | En los fluidos polares, las moléculas covalentes polares se disuelven. HCl en agua, por ejemplo. Solo los líquidos orgánicos son solubles en compuestos covalentes no polares. | Los productos químicos iónicos solo son solubles en disolventes polares como el agua porque son polares. Los líquidos inorgánicos son insolubles. |
| Formación | Se crean cuando se unen dos no metales con electronegatividades idénticas. Ninguno de los átomos tiene suficiente fuerza para sacar electrones del otro. Por motivos de estabilidad, comparten electrones del orbital más externo con sus vecinos. | Se crean cuando un metal (+ ion) y un no metal interactúan (-ve ion). Los metales son más fuertes que los no metales, y los no metales pueden obtener fácilmente electrones de los metales. Estos dos iones se atraen entre sí y crean una conexión iónica. |
| Conductividad | Los iones no se disocian de las moléculas covalentes no polares. Como resultado, no conduce la electricidad. En el agua, los compuestos covalentes polares se disocian rápidamente y actúan como buenos conductores eléctricos. HCl en agua, por ejemplo. | Los compuestos covalentes no polares no se descomponen en iones. Como resultado, no podrá conducir la electricidad. Los compuestos covalentes polares se descomponen fácilmente en agua y se comportan como buenos conductores eléctricos. Por ejemplo, HCl en agua. |
| Punto de fusion | Bajo | Alto |
| Punto de ebullición | Bajo | Alto |
| Ejemplo | metano, ácido clorhídrico | Cloruro de sodio, ácido sulfúrico |
Ejemplos de preguntas
Pregunta 1: ¿Qué es el enlace químico?
Responder:
El enlace químico es el proceso de redistribución de electrones entre dos o más átomos para que cada átomo alcance un estado electrónico estable.
Pregunta 2: ¿Cuáles son los tipos de enlaces químicos?
Responder:
Los enlaces covalentes, de hidrógeno, los contactos de van der Waals y los enlaces iónicos o electrovalentes son los cuatro enlaces químicos que se encuentran en la química.
Pregunta 3: ¿Qué enlaces químicos son los más fuertes?
Responder:
El enlace covalente es el enlace químico más poderoso. Debido al intercambio mutuo de electrones, se desarrollaron entre dos átomos. El agua es un ejemplo clásico de un enlace covalente porque tanto los átomos de hidrógeno como los de oxígeno intercambian electrones.
Pregunta 4: ¿Qué causa que el punto de fusión de un diamante sea tan alto?
Responder:
El diamante es un alótropo de carbono. Cada uno de los átomos de carbono en un diamante está unido covalentemente a otros cuatro átomos de carbono. Como resultado, se forma una estructura covalente masiva. Como resultado, el diamante es muy duro y tiene un punto de fusión muy alto.
Pregunta 5: ¿Qué son los enlaces covalentes polares?
Responder:
Cuando los electrones se comparten de manera desigual, este tipo de enlace covalente se forma porque la electronegatividad de los átomos que se unen varía. Para átomos más electronegativos, la atracción de electrones será más fuerte. La diferencia electronegativa entre los átomos es mayor que cero pero menor que 2.0. Como resultado, el par de electrones compartidos de ese átomo estarán más juntos.
Publicación traducida automáticamente
Artículo escrito por amanarora3dec y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA



