Dado que el modelo atómico de JJ Thomson era defectuoso y tenía importantes inconvenientes, Ernest Rutherford propuso un modelo más nuevo que sirvió como base para los siguientes modelos atómicos. En busca de respuestas sobre la disposición de los electrones dentro de un átomo, Rutherford llevó a cabo un experimento en el que las partículas alfa que se movían rápidamente golpeaban una fina lámina de oro.
Experimento de dispersión de partículas alfa (α) de Rutherford
Para determinar cómo se organizan los electrones en un átomo, Rutherford organizó el Experimento de dispersión de partículas alfa (α). Se dirigieron partículas α que se movían rápidamente para bombardear una fina lámina de oro.
- La lámina de oro se seleccionó para obtener una capa extremadamente fina. El espesor de la lámina de oro era de unos 1000 átomos.
- Los iones de helio doblemente cargados se conocen como partículas α. Las partículas α que se mueven rápidamente poseen una gran cantidad de energía, ya que tienen una masa de aproximadamente 4 amu.
La hipótesis era que las partículas α serían desviadas por las partículas subatómicas en los átomos de oro. Rutherford no esperaba presenciar desviaciones significativas ya que las partículas α eran considerablemente más pesadas que los protones. Sin embargo, el experimento produjo resultados completamente inesperados.
Observaciones
Rutherford observó lo siguiente de su experimento de dispersión de partículas α:
- La mayoría de las partículas α de rápido movimiento atravesaron directamente la lámina de oro.
- La lámina desvió algunas de las partículas α en ángulos bastante pequeños.
- Solo unas pocas partículas α se desviaron por completo (en 180 grados).

Figura 1. Experimento de dispersión de partículas alfa de Rutherford (arriba)
Conclusión
Rutherford concluyó lo siguiente a partir de sus observaciones:
- Debido a que una gran proporción de las partículas α dirigidas hacia la lámina de oro la atravesaron sin desviarse, la mayor parte del espacio en un átomo está vacante.
- Solo unas pocas partículas α se desviaron de su ruta, lo que sugiere que la carga positiva del átomo ocupa relativamente poco espacio.
- Dado que un porcentaje muy pequeño de partículas α rebotó por completo, esto implica que la masa y la carga positiva del átomo se concentran en un volumen pequeño y no se distribuyen uniformemente.
Modelo atómico de Rutherford
El modelo atómico de Rutherford también se conoce como modelo atómico nuclear.
Características del modelo atómico de Rutherford:
Rutherford formuló la hipótesis de la estructura atómica de los elementos basándose en las observaciones y conclusiones establecidas anteriormente. El modelo atómico de Rutherford establece:
- Las partículas con carga positiva y la mayor parte de la masa de un átomo se concentraron en un volumen increíblemente pequeño. Se refirió a esta porción del átomo como el núcleo. Este núcleo es de tamaño muy pequeño, en comparación con el tamaño del átomo en su conjunto.
- Según Rutherford, los electrones cargados negativamente rodean el núcleo de un átomo. Creía que los electrones que rodean al núcleo viajan a su alrededor en rutas circulares a grandes velocidades. Se refirió a estas rutas circulares como órbitas bien definidas.
El núcleo y los electrones se mantenían unidos por fuerzas de atracción electrostática.
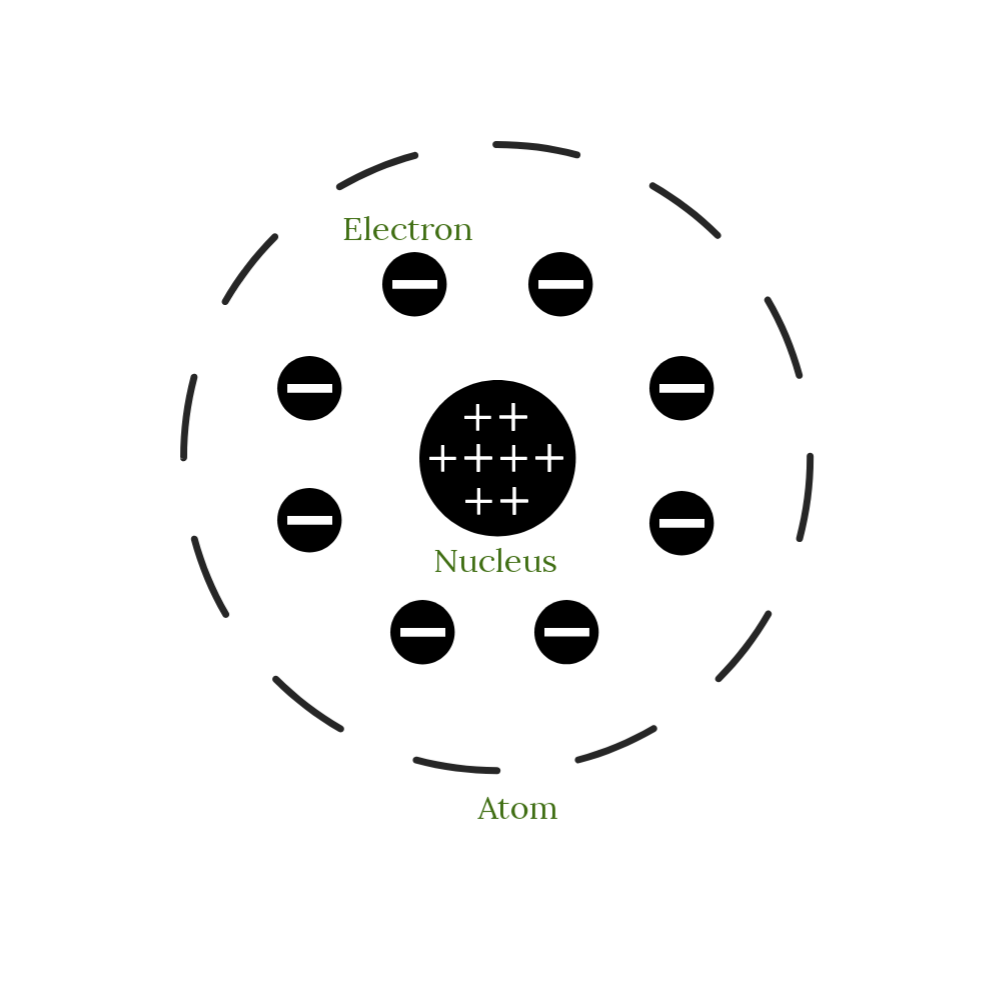
Figura 2. Modelo del átomo de Rutherford (arriba)
Inconvenientes del modelo atómico de Rutherford
- El modelo de Rutherford predice que los electrones orbitarán alrededor del núcleo con carga positiva, que no se prevé que sea estable. Una partícula cargada en movimiento rápido a lo largo de una ruta circular perdería energía continuamente y eventualmente colapsaría en el núcleo. Esto hace que un átomo sea inestable, mientras que sabemos que los átomos son extremadamente estables.
- Debido a que simplemente postuló la existencia de protones en el núcleo, el modelo de Rutherford no pudo resolver el problema de la masa atómica.

Figura 3. El inconveniente del Modelo del Átomo de Rutherford
Ejemplos de preguntas
Pregunta 1: ¿Por qué era defectuoso el modelo atómico de JJ Thomson?
Responder:
El modelo atómico de Thomson no explica cómo se mantiene la carga positiva de los electrones dentro del átomo. Tampoco logra explicar la estabilidad de un átomo. El núcleo de un átomo no se menciona en la hipótesis. No podía explicar el experimento de dispersión de Rutherford.
Pregunta 2: Explique brevemente el experimento de dispersión de Rutherford.
Responder:
Para determinar cómo se organizan los electrones en un átomo, Rutherford organizó el Experimento de dispersión de partículas alfa (α). Se dirigieron partículas α que se movían rápidamente para bombardear una fina lámina de oro. La lámina de oro se seleccionó para obtener una capa extremadamente fina. El espesor de la lámina de oro era de unos 1000 átomos. Los iones de helio doblemente cargados se conocen como partículas α. Las partículas α que se mueven rápidamente poseen una gran cantidad de energía, ya que tienen una masa de aproximadamente 4 amu.
La hipótesis era que las partículas α serían desviadas por las partículas subatómicas en los átomos de oro. Rutherford no esperaba presenciar desviaciones significativas ya que las partículas α eran considerablemente más pesadas que los protones. Sin embargo, el experimento produjo resultados completamente inesperados.
Pregunta 3: ¿Qué partícula subatómica descubrió Rutherford a través de su experimento de dispersión de partículas alfa (α)?
Responder:
La partícula subatómica descubierta por Rutherford a través de su experimento de dispersión de partículas alfa (α) fue el núcleo .
Pregunta 4: ¿Por qué se utilizó una lámina de oro en el experimento de dispersión de partículas alfa (α)?
Responder:
Se seleccionó una lámina de oro para obtener una capa extremadamente delgada y por ser el metal más maleable. Sin embargo, si se usara cualquier otra lámina metálica, los resultados obtenidos serían consistentes.
Pregunta 5: ¿Cuál fue el principal inconveniente del modelo del átomo de Rutherford?
Responder:
El modelo de Rutherford predice que los electrones orbitarán alrededor del núcleo con carga positiva, que no se prevé que sea estable. Una partícula cargada en movimiento rápido a lo largo de una ruta circular perdería energía continuamente y eventualmente colapsaría en el núcleo. Esto hace que un átomo sea inestable, mientras que sabemos que los átomos son extremadamente estables.
Pregunta 6: ¿En qué ángulos se desviaron las partículas α en el experimento de dispersión?
Responder:
La mayoría de las partículas α de rápido movimiento atravesaron directamente la lámina de oro. La lámina desvió algunas de las partículas α en ángulos bastante pequeños. Solo unas pocas partículas α se desviaron por completo (en 180 grados).
Pregunta 7: ¿Cómo definió Rutherford una órbita?
Responder:
Según Rutherford, los electrones cargados negativamente rodean el núcleo de un átomo. Creía que los electrones que rodean al núcleo viajan a su alrededor en rutas circulares a grandes velocidades. Se refirió a estas rutas circulares como órbitas bien definidas.
Publicación traducida automáticamente
Artículo escrito por ridakbug20cse y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA