Un proceso en el que uno o más reactivos se combinan para formar una o más sustancias diferentes, llamadas productos . Las sustancias formadoras se denominan elementos o compuestos químicos . Una reacción química da como resultado el reordenamiento de los átomos constituyentes de los reactivos para dar como resultado la formación de productos. La apariencia física de los reactivos es diferente a la de los productos. Las reacciones químicas ocurren continuamente en el entorno general, por ejemplo, la oxidación del hierro o la fermentación del vino, etc.
¿Qué es una reacción química?
Las reacciones químicas dan como resultado la conversión de productos químicos o sustancias en una o más sustancias. Los grupos de átomos se reorganizan y conducen a la ruptura y formación de enlaces químicos en una reacción química.
Estas reacciones van acompañadas de la aparición de gas, precipitado, y color, luz. Por ejemplo, si consideramos la reacción de oxidación del propano, resulta en la liberación de calor y luz, denotada por la siguiente reacción,
C 3 H 8 + 5O 2 → 3CO 2 + 4H 2 O
Terminología asociada con las reacciones químicas:
- Dos o más moléculas se asocian entre sí para formar nuevos productos en una reacción química.
- Los compuestos que reaccionan entre sí se denominan reactivos, mientras que los compuestos recién formados se denominan productos.
- La velocidad de reacción está moderada por factores como la presión, la temperatura y la concentración de los reactivos.
- Una reacción química también va acompañada de cambios físicos, observables por el ojo humano, por ejemplo, precipitación, producción de calor, cambio de color, etc.
Tipos de reacciones químicas
Hay varios tipos de reacciones químicas basadas en la forma en que los reactivos se combinan, los subproductos, etc., por ejemplo,
- Reacción de combinación: la reacción química ocurre cuando dos elementos, o un elemento y un compuesto o dos compuestos se agregan para formar un solo producto, se denomina reacción de combinación.
- Reacción de descomposición: la reacción química que ocurre cuando se produce la división de un compuesto en dos o más subproductos más simples se denomina reacción de descomposición.
- Reacción de desplazamiento: este tipo de reacción química ocurre cuando un metal más reactivo desplaza a un metal menos reactivo.
- Reacción de doble desplazamiento: Las reacciones en las que se intercambian iones entre dos reactivos que forman nuevos compuestos se denominan reacciones de doble desplazamiento.
- Reacción de precipitación: este tipo de reacción química va acompañada de la formación de un compuesto insoluble llamado precipitado que se forma en este tipo de reacciones.
- Reacción exotérmica: Las reacciones químicas que producen energía se denominan reacciones exotérmicas. En su mayoría, las reacciones de descomposición son exotérmicas.
- Reacción endotérmica: Las reacciones químicas que absorben energía se denominan reacciones endotérmicas. En su mayoría, las reacciones de combinación son endotérmicas. Estas reacciones son inversas a las reacciones exotérmicas.
- Reacción de oxidación: las reacciones de oxidación van acompañadas de la ganancia de oxígeno o la eliminación de hidrógeno o elemento metálico del compuesto químico.
- Reacción de reducción: las reacciones de reducción van acompañadas de la pérdida de oxígeno o la ganancia de hidrógeno o elemento metálico del compuesto químico. Estas reacciones son inversas a las reacciones de oxidación.
- Reacción redox: Las reacciones químicas donde la oxidación y la reducción tienen lugar simultáneamente también se conocen como reacción redox, formada por las palabras, reducción y oxidación.
Ecuaciones Químicas
Las ecuaciones químicas se denotan usando fórmulas químicas y símbolos para representar los cambios que ocurren entre los reactivos y los productos.
Una ecuación química está representada por los reactivos escritos en el lado izquierdo y los productos en el lado derecho. Un símbolo, posiblemente una flecha, también indica la dirección de la reacción. Asimismo, a cada una de las entidades reaccionantes se le asigna su correspondiente coeficiente estequiométrico.
Ejemplos de ecuaciones químicas son:
- PCl 5 + 4H 2 O → H 3 PO 4 + 5HCl
- SnO2 + 2H2 → 2H2O + Sn
- TiCl4 + 2H2O → TiO2 + 4HCl
- Na2S + 2AgI → 2NaI + Ag2S
Agentes Oxidantes
Las sustancias que pueden oxidar otras sustancias se denominan agentes oxidantes. Por lo tanto, el agente oxidante actúa como un grupo aceptor de electrones, ya que aceptan electrones. Estos agentes tienen la propiedad de reducirse siempre y oxidar otra sustancia.
Los agentes oxidantes también pueden denominarse oxidantes o reactivos de oxigenación o agentes de transferencia de átomos de oxígeno (OAT). Algunos de los ejemplos comunes de agentes oxidantes son el oxígeno, el perrust de hidrógeno y los halógenos. Todos los agentes oxidantes son rusts por naturaleza.
Estos grupos son los encargados de transferir los átomos de oxígeno al sustrato. Sin embargo, algunas de las reacciones redox, oxidación-reducción, tienen lugar en ausencia de átomos de oxígeno. Algunos de los ejemplos de agentes oxidantes son MnO 4 – , CrO 4 -2 , etc.
Los agentes oxidantes comunes son,
- Compuestos de oxígeno, como oxígeno (O 2 ) y ozono (O 3 )
- Ácido nítrico (HNO 3 ) y compuestos de nitrato
- Hipoclorito, clorito, clorato, perclorato y otros compuestos halógenos análogos como lejía doméstica (NaClO)
- Compuestos de permanganato como el permanganato de potasio (KMnO 4 )
- perborato de sodio
- Halógenos, como flúor (F 2 ), cloro (Cl 2 )
- Perrust de hidrógeno (H2O2) y otros perrusts inorgánicos, reactivo de Fenton
- ácido peroximonosulfúrico
- dicromato de sodio
- Compuestos de nitrógeno, como rust nitroso, dirust de nitrógeno/tetrrust de dinitrógeno (NO 2 / N 2 O 4 )
- Nitrato de potasio (KNO3), el oxidante en polvo negro
- Bismutato de sodio (NaBiO 3 )
- Dirust de plomo (PbO 2 )
Aplicaciones de Agentes Oxidantes
Los agentes oxidantes encuentran su uso en un gran número de aplicaciones comerciales e industriales, algunas de las cuales son,
- Purificación de agua.
- Almacenamiento de energía en baterías.
- Combustión de gasolina.
- Blanqueo de tejidos.
- Procesos biológicos como el metabolismo y la fotosíntesis.
- Vulcanización del caucho (aumento de la resistencia y la elasticidad del caucho).
Agentes reductores
Un agente reductor es un elemento o compuesto que pierde o “dona” un electrón a un receptor de electrones. El recipiente es el agente oxidante, como se describió anteriormente. Por lo tanto, los agentes reductores también se denominan reductores, reductores o donantes de electrones.
Por lo tanto, ambos compuestos químicos encuentran su uso en las reacciones redox. El estado de oxidación del agente reductor aumenta mientras que por el contrario el agente oxidante disminuye. Por lo tanto, los agentes reductores “reducen” los oxidantes al disminuir su estado de oxidación mientras que los agentes oxidantes “oxidan” los reductores al aumentar su estado de oxidación. Además, se sabe que los metales del bloque s en la tabla periódica actúan como buenos agentes reductores.
Cualquier buen agente reductor consta de átomos que tienen baja electronegatividad y una buena tendencia a atraer los electrones de enlace que tienen energías de ionización despreciablemente bajas.
Características del agente reductor
- Los agentes reductores tienden a ceder electrones y oxidarse. Esto también hace que el otro reactivo se reduzca al suministrarle electrones.
- Dado que dan electrones, se vuelven menos cargados negativamente, es decir, se mueven hacia los cargados positivamente.
- Cuanto mayor es la tendencia a perder electrones, más fuerte es el agente reductor. Esto se debe a que el agente reductor reducirá las otras sustancias al donar electrones de manera poderosa.
- Las reacciones de oxidación y reducción implican la transferencia de electrones durante las reacciones.
Los siguientes son los agentes reductores comunes,
- Borohidruro de sodio
- Hidruro de litio y aluminio (LiAlH 4 )
- Ácidos, como el ácido oxálico y el ácido fórmico
- Amalgamas, como amalgama de zinc y amalgama de sodio
- diborano
- Aleación de plomo y sodio
- Hidrógeno naciente
- Tiosulfatos
Identificación de agentes oxidantes y reductores
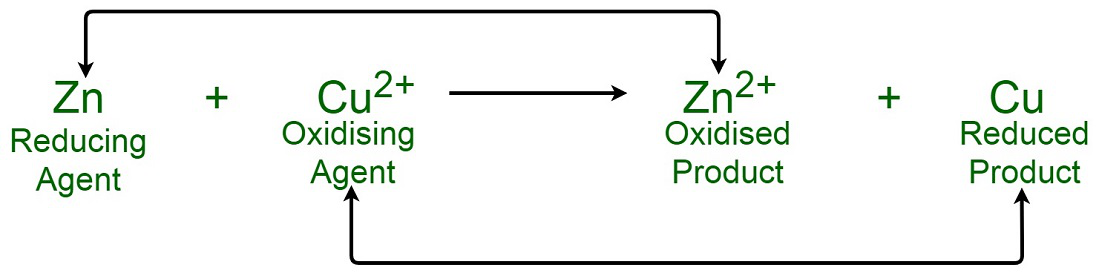
Una reacción de oxidación es un tipo de reacción química en la que hay una pérdida de un electrón de una sustancia. Una reacción de reducción, por el contrario, es una reacción que proporciona un electrón a una sustancia. Una reacción redox es una combinación de reacción de oxidación y reducción en la que una de las sustancias cede un electrón y otra sustancia toma ese electrón.
Para identificar un agente oxidante, la información puede obtenerse del número de oxidación de un átomo antes y después de la reacción. Un aumento en el número de oxidación del compuesto hacia el lado del producto se debe a que la sustancia perdió electrones y se oxidó. Una disminución en el número de oxidación del compuesto hacia el lado del producto se debe a que la sustancia ganó electrones y se redujo. La sustancia que se reduce en una reacción es el agente oxidante porque gana electrones. La sustancia que se oxida en una reacción es el agente reductor porque perdió electrones. La siguiente tabla resume la discusión anterior:
|
Nombre |
Número de oxidación |
Cambio en electrones |
|
Oxidación |
aumenta |
se pierden electrones |
|
Reducción |
Disminuye |
Se ganan electrones |
|
Agente oxidante |
Disminuye |
Se ganan electrones |
|
Agente reductor |
aumenta |
se pierden electrones |
Ejemplos de preguntas
Pregunta 1: Diferenciar entre agente oxidante y agente reductor.
Responder:
Las siguientes son las diferencias entre el agente oxidante y el agente reductor:
Agente reductor
agente oxidante
Un agente reductor puede oxidarse al perder algunos de sus electrones. Un agente oxidante puede reducirse obteniendo electrones. El estado de oxidación del agente reductor aumenta. El estado de oxidación del agente oxidante disminuye. Donante de electrones. Receptor de electrones. El agente reductor se oxida durante la reacción. Reducido durante la reacción. Responsable de causar la reducción de otro reactivo. Responsable de causar la oxidación de otro reactivo.
Pregunta 2: Describa una reacción de oxidación donde la oxidación de un estado de oxidación positivo aumenta durante la reacción.
Responder:
Como sabemos, se sabe que el H 2 C 2 O 4 es un buen agente reductor. En esta composición química, el estado de oxidación del átomo de C es +3. El estado de oxidación más alto que puede alcanzar el átomo de C es +4. Por tanto, podemos llevar a cabo su oxidación a CO 2 . Por lo tanto, la semirreacción viene dada por,
H 2 C 2 O 4 → 2CO 2 + 2H + + 2e –
Pregunta 3: El ácido sulfúrico y el ácido clorhídrico no son agentes oxidantes en comparación con el ácido nítrico. Explicar por qué.
Responder:
El ácido clorhídrico actúa como agente reductor, ya que pierde un átomo de hidrógeno. De este modo, lleva a cabo la reducción de otras sustancias y se oxida a cloro. Del mismo modo, el ácido sulfúrico actúa como un agente oxidante que al realizar la descomposición térmica da lugar al oxígeno naciente. El ácido nítrico (HNO 3 ) se considera un poderoso agente oxidante y las propiedades oxidantes se deben a la producción de oxígeno naciente que da al descomponerse.
Pregunta 4: Identifique el agente reductor en las siguientes reacciones:
4NH 3 + 5O 2 ⇢ 4NO +6H 2 O
H 2 O + F 2 ⇢ HF + HOF
Responder:
En la primera reacción, el amoníaco (NH 3 ) es el agente reductor, ya que el estado de oxidación del oxígeno se reduce de 0 a -1. El halógeno, el Flúor (F 2 ), sufre la reacción de reducción, actuando por tanto como agente oxidante. Por lo tanto, el agua (H 2 O) es un agente reductor aquí.
Pregunta 5: ¿Por qué el agua regia disuelve los metales nobles?
Responder:
Sabemos que la formación de agua regia se puede representar mediante la siguiente reacción química:
HNO3 + 3HCl → NOCl + 2H2O + 2Cl2
es decir, el ácido nítrico reacciona con el ácido clorhídrico para formar una mezcla llamada agua regia como producto final. El lado derecho contiene un producto llamado cloruro de nitrosilo NOCl, que es un agente oxidante más fuerte que el ácido nítrico. Por lo tanto, el ácido nítrico puro no disuelve los metales nobles pero el agua regia los disuelve fácilmente.
Pregunta 6: ¿Qué son las reacciones redox?
Responder:
Las reacciones redox están formadas por la combinación de los términos reacciones químicas de oxidación-reducción en las que los reactivos, es decir, los átomos y moléculas constituyentes, sufren un cambio en sus estados de oxidación. Todas las reacciones redox se pueden dividir en dos procesos diferentes: un proceso de reducción y un proceso de oxidación que ocurren simultáneamente.
Pregunta 7: ¿Por qué se considera que el oxígeno es un agente oxidante? Explique usando una reacción con un metal.
Responder:
El oxígeno en forma elemental es un fuerte agente oxidante. El oxígeno muestra una buena reactividad y se combina fácilmente con la mayoría de los otros elementos y muchos compuestos. Cuando un compuesto como el magnesio reacciona con el oxígeno, los átomos de magnesio ceden o donan electrones a las moléculas de oxígeno (O 2 ). Esto resulta en la reducción de oxígeno. Por lo tanto, el magnesio metálico actúa como agente reductor. Por lo tanto, el magnesio se oxida. El oxígeno, por lo tanto, es un agente oxidante en este caso.