Un metal es un material que tiene una apariencia brillante cuando está recién producido, pulido o roto, y conduce la electricidad y el calor razonablemente bien. Los metales son maleables o dúctiles (se pueden martillar en láminas delgadas) (se pueden estirar en alambres). Los metales pueden ser elementos químicos como el hierro, aleaciones como el acero inoxidable o compuestos moleculares como el nitruro de azufre polimérico.
El término «metal» se usa de manera más amplia en astrofísica para referirse a todos los elementos químicos en una estrella que son más pesados que el helio, en lugar de solo los metales clásicos. En este sentido, los primeros cuatro «metales» que se acumulan en los núcleos de las estrellas a través de la nucleosíntesis son el carbono, el nitrógeno, el oxígeno y el neón, que son químicamente no metales. A lo largo de su existencia, una estrella fusiona elementos más ligeros, principalmente hidrógeno y helio, en átomos más pesados. En este contexto, la metalicidad de un objeto astronómico se refiere a la proporción de su masa compuesta por elementos químicos más pesados.
Oxidación del hierro
La oxidación es el fenómeno de una capa de color marrón rojizo que se forma en la superficie del hierro debido a la acción del aire húmedo, y la capa de color marrón rojizo se conoce como rust. En pocas palabras, el rust es una sustancia escamosa de color marrón rojizo que se forma cuando un objeto de hierro se expone al aire húmedo durante un período prolongado. La oxidación es el término para este fenómeno.
La oxidación del hierro y el acero es el ejemplo más frecuente de corrosión metálica. La oxidación de los sistemas de escape y la carrocería de los vehículos, las tuberías de agua y muchos tipos de estructuras de acero son ejemplos bien conocidos. La acción combinada del aire y el agua sobre el hierro provoca su oxidación. La oxidación no ocurre en aire completamente seco o en aire que está completamente desprovisto de agua. Las condiciones atmosféricas y las contribuciones relativas de los componentes que regulan la oxidación definen la composición particular de la rust. Se compone principalmente de rust férrico hidratado, por lo que la fórmula química del rust es Fe 2 O 3 .xH 2 O . La siguiente respuesta puede caracterizar aproximadamente su formación:
4Fe + 3O 2 +2xH 2 O → 2Fe 2 O 3 .xH 2 O
La superficie exterior del hierro se oxida primero en presencia de aire húmedo y una capa de rust férrico hidratado (rust) se deposita sobre la superficie. Esta capa es delicada y porosa, y si se vuelve demasiado gruesa, puede caerse. Las capas más bajas de hierro están expuestas al medio ambiente, lo que hace que se oxiden. El hierro finalmente pierde su fuerza a medida que continúa el proceso.
¿Cuál es el proceso de oxidación del hierro?
La oxidación del hierro es una reacción de oxidación. Durante la oxidación, el hierro se combina con el oxígeno del aire en presencia de agua para generar Fe 2 O 3 .xH 2 O, un rust de hierro (III) hidratado.
Este rust de hierro (III) hidratado se conoce como rust. Como resultado, el rust es en gran parte rust de hierro (III) hidratado, Fe 2 O 3 .xH 2 O. El color del rust es marrón rojizo. Todos hemos notado rust de color marrón rojizo en clavos, tornillos, tuberías y barandillas de hierro. Cuando se expone al aire húmedo, no solo el hierro, sino también el acero, se oxida. El acero, por otro lado, es más resistente al rust que el hierro.
La oxidación del hierro es un cambio químico
El rust se forma cuando el hierro (o una aleación de hierro) se expone al oxígeno en presencia de humedad. Esta reacción no es instantánea; más bien, tiene lugar durante un largo período de tiempo. Los rusts de hierro se forman cuando los átomos de oxígeno se combinan con los átomos de hierro. Como resultado, los enlaces entre los átomos de hierro en el objeto/estructura se debilitan.
El estado de oxidación del hierro aumenta como resultado de la reacción de oxidación, a la que sigue la pérdida de electrones. El rust se compone principalmente de dos tipos de rusts de hierro que difieren en el estado de oxidación del átomo de hierro. Estos son los rusts:
- El rust de hierro (II) también se conoce como rust ferroso. Esta sustancia tiene un estado de oxidación de +2 y la fórmula química FeO.
- El rust de hierro (III), a menudo conocido como rust férrico, es un compuesto en el que el átomo de hierro tiene un estado de oxidación de +3. Fe2O3 es la fórmula química de esta sustancia.
El hierro es un agente reductor, pero el oxígeno es un excelente agente oxidante. Cuando se expone al oxígeno, el átomo de hierro fácilmente cede electrones. La reacción química se describe de la siguiente manera:
Fe → Fe 2+ + 2e –
Cuando el agua está presente, el átomo de oxígeno aumenta el estado de oxidación del hierro.
4Fe2 + + O2 → 4Fe3 + + 2O2-
Los cationes de hierro y las moléculas de agua experimentan ahora las siguientes reacciones ácido-base.
Fe 2+ + 2H 2 O ⇌ Fe(OH) 2 + 2H +
Fe 3+ + 3H 2 O ⇌ Fe(OH) 3 + 3H +
La reacción directa entre los cationes de hierro y los iones de hidrrust también produce hidrrusts de hierro.
O 2 + H 2 O + 4e – → 4OH –
Fe2 + + 2OH – → Fe(OH) 2
Fe3+ + 3OH – → Fe (OH) 3
Los hidrrusts de hierro que resultan ahora están deshidratados, produciendo los rusts de hierro que forman el rust. Muchos procesos químicos están involucrados en este proceso, algunos de los cuales se dan a continuación.
- Fe(OH) 2 ⇌ FeO + H 2 O
- 4Fe(OH) 2 + O 2 + xH 2 O → 2Fe 2 O 3 .(x+4)H 2 O
- Fe(OH) 3 ⇌ FeO(OH) + H 2 O
- FeO(OH) ⇌ Fe 2 O 3 + H 2 O\
Todas las reacciones químicas enumeradas anteriormente tienen una cosa en común: todas requieren la presencia de agua y oxígeno. Como resultado, la cantidad de oxígeno y agua que rodea el metal puede limitarse para evitar la oxidación.
Las condiciones necesarias para la oxidación del hierro son:
Muchos factores contribuyen a la oxidación del hierro, incluida la cantidad de humedad en el aire y el pH del entorno circundante. Los siguientes son algunos de estos elementos.
- Humedad: La disponibilidad de agua en el ambiente limita la corrosión del hierro. La causa más frecuente de oxidación es la exposición a la lluvia.
- El proceso de oxidación se acelera si el pH del ambiente alrededor del metal es bajo. Cuando el hierro se expone a la lluvia ácida, se oxida más rápidamente. La corrosión del hierro se ralentiza con un pH más alto.
- Debido a la presencia de diversas sales en el agua, el hierro se oxida más rápidamente. Muchos iones en el agua salada aceleran el proceso de oxidación a través de procesos electroquímicos.
- Impureza: en comparación con el hierro que tiene una variedad de metales, el hierro puro se oxida más lentamente.
El tamaño del objeto de hierro también puede influir en la rapidez con la que se oxida. Un objeto de hierro enorme, por ejemplo, probablemente tenga fallas menores debido al proceso de fundición. Estos defectos proporcionan una plataforma para los ataques ambientales al metal.
Experimento para demostrar que el aire y la humedad son esenciales para la oxidación:
Procedimiento para demostrar que la oxidación requiere humedad y aire.
- Se deben colocar clavos de hierro limpios en cada uno de los tres frascos de prueba etiquetados A, B y C.
- Llene el tubo de ensayo A con agua del grifo y tápelo.
- Llene el tubo de ensayo B con agua destilada caliente, luego agregue aproximadamente 1 ml de aceite y tápelo. El aceite flotará en la superficie del agua, evitando que el aire se evapore.
- Llene el tubo de ensayo C con cloruro de calcio anhidro y tápelo. Cualquier humedad en el aire será absorbida por el cloruro de calcio anhidro.
- Espere unos días para que estos tubos de ensayo se asienten antes de observar.
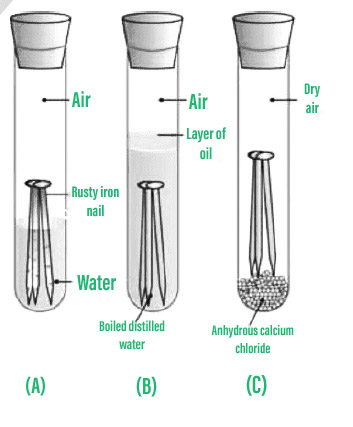
Observación: Los clavos de hierro se oxidan en la probeta A pero no en las probetas B y C, según los resultados. Los clavos en el tubo de ensayo A se corroyeron porque estuvieron expuestos tanto al aire como al agua. Las uñas del tubo de ensayo B están expuestas únicamente al agua, pero las uñas del tubo de ensayo C están expuestas al aire seco.
Conclusión: Este experimento demuestra que la oxidación requiere tanto aire (oxígeno) como humedad para que ocurra.
¿Cuáles son los daños causados por la oxidación de los objetos de hierro?
El rust es permeable y suave, y cuando se desliza de la superficie de un objeto de hierro oxidado, el hierro que se encuentra debajo se oxida. Como resultado, la oxidación del hierro es un proceso constante que desgasta los artículos de hierro con el tiempo, dejándolos sin valor. La oxidación del hierro causa daños significativos con el tiempo, ya que se utiliza para construir una amplia gama de estructuras y productos básicos, incluidos puentes, rejillas, barandas, puertas y carrocerías de automóviles, autobuses, camiones y barcos. No hace falta decir que deberíamos tener una manera de evitar que el hierro se oxide.
Prevención de la oxidación del hierro
La pérdida de objetos de hierro por oxidación tiene un gran impacto económico en el país y debe evitarse. Para evitar que las cosas de hierro se oxiden, se emplea una variedad de técnicas. Para mantener fuera el aire y el agua, la mayoría de las formas requieren cubrir la pieza de hierro con algo. Las siguientes son algunas de las formas más frecuentes de evitar que el hierro se oxide:
- La oxidación del hierro se puede prevenir pintando: Cubrir la superficie del hierro con pintura es la forma más popular de evitar que se oxide. Cuando la pintura se coloca sobre la superficie de un objeto de hierro, evita que el aire y la humedad entren en contacto con el objeto, evitando la oxidación. Para evitar la oxidación, las rejillas de las ventanas, las barandillas, los puentes de hierro, los muebles de acero, los vagones de ferrocarril y las carrocerías de los automóviles, autobuses y camiones, entre otras cosas, se pintan con regularidad.
- La oxidación del hierro se puede prevenir aplicando grasa o aceite: cuando se coloca grasa o aceite en la superficie de un objeto de hierro, se evita que el aire y la humedad entren en contacto con él, lo que evita la corrosión. Las herramientas de hierro y acero y las piezas de máquinas, por ejemplo, se frotan con grasa o aceite para evitar la corrosión.
- La oxidación del hierro se puede prevenir mediante la galvanización: la galvanización protege contra la oxidación los artículos expuestos a una humedad excesiva, como las láminas de techo y las tuberías. La galvanización es la técnica de aplicar una fina capa de zinc al acero y al hierro para evitar la oxidación. El hierro galvanizado es hierro que ha sido recubierto de zinc. El zinc es más reactivo que el hierro, por lo tanto, en presencia de humedad, interactúa con el oxígeno para generar una capa invisible de rust de zinc que lo protege de una mayor oxidación. Vale la pena señalar que incluso si se rompe el revestimiento de zinc de los productos de hierro galvanizado, permanecen libres de rust. Debido a que el zinc es más reactivo que el hierro, este es el caso.
- La oxidación del hierro se puede prevenir mediante galvanoplastia: la galvanoplastia es otro método para evitar que los artículos se oxiden. En este procedimiento, los metales no corrosivos, incluidos el estaño, el níquel y el cromo, se galvanizan sobre hierro. Esta técnica no solo evita que los productos se oxiden, sino que también mejora su belleza. Los sanitarios y elementos de vehículos como manillares de bicicletas, parachoques de coches, etc. son ejemplos de elementos cromados.
- La oxidación del hierro puede prevenirse aleándolo para hacer acero inoxidable: El acero inoxidable se crea cuando el hierro se alea con cromo y níquel. El acero inoxidable es impermeable al rust. Los utensilios de cocina de acero inoxidable, las tijeras y el equipo médico, por ejemplo, no se corroen. El acero inoxidable, por otro lado, es demasiado caro para ser utilizado en grandes cantidades.
- La oxidación del hierro se puede prevenir mediante el estañado: el estaño no es tóxico y su reactividad es menor que la del hierro. Las latas de comida están enlatadas, lo que implica que tienen una fina capa de estaño sobre ellas. Como resultado, cuando se deposita una fina capa electrochapada de metal de estaño sobre artículos de hierro y acero, los objetos de hierro y acero quedan protegidos contra la oxidación. Se utilizan cajas tiffin enchapadas en estaño porque no son tóxicas y no contaminan los alimentos que contienen.
- La oxidación del hierro se puede prevenir mediante el esmaltado: el esmaltado es un procedimiento de alta temperatura que consiste en fundir vidrio en polvo en un sustrato de metal. Los esmaltes se pueden usar en una variedad de superficies, incluidos vidrio y cerámica.
Problemas de muestra
Pregunta 1: ¿Cuál es el proceso de oxidación del hierro?
Responder:
La oxidación del hierro es una reacción de oxidación. En presencia de agua, el metal de hierro interactúa con el oxígeno del aire para generar rust de hierro (III) hidratado, Fe 2 O 3 .xH 2 O. Este rust de hierro (III) hidratado se conoce como rust. Como resultado, el rust es en gran parte rust de hierro (III) hidratado, Fe 2 O 3 .xH 2 O. El rust es un tono marrón rojizo
Pregunta 2: ¿Cómo se llama la oxidación del hierro?
Responder:
La oxidación es el fenómeno de la formación de una capa de color marrón rojizo en la superficie del hierro debido a la acción del aire húmedo, y la capa de color marrón rojizo se conoce como rust.
Pregunta 3: ¿Cómo se puede prevenir la oxidación del hierro?
Responder:
La oxidación del hierro se puede prevenir
- Aplicar pintura
- Aplicar grasa o aceite
- Por galvanización
- Por galvanoplastia
- Uso de aleación de hierro para hacer acero inoxidable.
- por estañado
- Usando Esmaltado
Pregunta 4: ¿Qué es el rust? ¿Dé la ecuación para la formación de rust?
Responder:
Cuando el hierro se expone al aire durante un período prolongado, se oxida y desarrolla un rust de hierro de color marrón rojizo en la superficie. Rust es el nombre de este material de color marrón rojizo.
El rust se forma a través de la siguiente ecuación:
4Fe + 3O 2 +2xH 2 O → 2Fe 2 O 3 .xH 2 O
Pregunta 5: ¿Cómo daña el rust los objetos de hierro?
Responder:
El rust es permeable y suave, y cuando se desliza de la superficie de un objeto de hierro oxidado, el hierro que se encuentra debajo se oxida. Como resultado, la oxidación del hierro es un proceso constante que desgasta los artículos de hierro con el tiempo, dejándolos sin valor. La oxidación del hierro causa daños significativos con el tiempo, ya que se utiliza para construir una amplia gama de estructuras y productos básicos, incluidos puentes, rejillas, barandas, puertas y carrocerías de automóviles, autobuses, camiones y barcos. No hace falta decir que deberíamos tener una manera de evitar que el hierro se oxide.
Pregunta 6: ¿Cuáles son las condiciones necesarias para la oxidación?
Responder:
Muchos factores contribuyen a la oxidación del hierro, incluida la cantidad de humedad en el aire y el pH del entorno circundante. Los siguientes son algunos de estos elementos.
- Humedad: La disponibilidad de agua en el ambiente limita la corrosión del hierro. La causa más frecuente de oxidación es la exposición a la lluvia.
- El proceso de oxidación se acelera si el pH del ambiente alrededor del metal es bajo. Cuando el hierro se expone a la lluvia ácida, se oxida más rápidamente. La corrosión del hierro se ralentiza con un pH más alto.
- Debido a la presencia de diversas sales en el agua, el hierro se oxida más rápidamente. Muchos iones en el agua salada aceleran el proceso de oxidación a través de procesos electroquímicos.
- Impureza: en comparación con el hierro que tiene una variedad de metales, el hierro puro se oxida más lentamente.
Pregunta 7: ¿Cómo es que el rust de hierro es un cambio químico?
Responder:
El rust está formado por rust de hierro (Fe2O3). En consecuencia, rust y hierro no son sinónimos. El rust no es lo mismo que el hierro sobre el que se deposita. Debido a que se crea un nuevo componente denominado «rust de hierro» durante la oxidación del hierro, representa un cambio químico.
Publicación traducida automáticamente
Artículo escrito por amanarora3dec y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA