El cambio de estado en una sustancia es un cambio físico en una materia. Estos cambios acomodan cambios reversibles, es decir, los cambios que se pueden cambiar de un estado físico a otro. No implica ningún cambio químico. Los cambios se producen debido a las variaciones observadas en la temperatura o la presión de una sustancia. Por ejemplo, al aumentar la temperatura aumenta la interacción intramolecular entre las partículas, por lo que la sustancia se mueve más libremente. Al disminuir la temperatura, las sustancias se depositan en una estructura fija y rígida. Gobernados por los tres estados de la materia, los diferentes procesos que se encuentran en el ciclo son fusión, congelación, sublimación, deposición, condensación y vaporización.

Los cambios en las fases de una sustancia dan como resultado el cambio en la composición de una sustancia. Los sólidos tienen estructuras rígidas y volúmenes fijos. Esto se debe a que en los sólidos las fuerzas de atracción intramoleculares son más fuertes que las de los enlaces de hidrógeno. Esto está en completa comparación con el estado del gas que no tiene un volumen definido ni una forma definida. Porque las partículas están débilmente unidas entre sí y se les permite moverse y transmitirse en todas las direcciones. Se expande hasta ocupar todo el recipiente en el que se coloca.
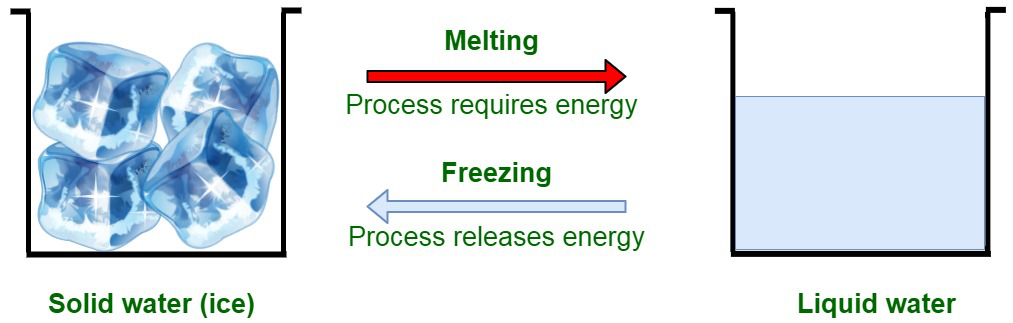
Cuando el calor se libera a través del sistema, se produce la transición del estado gaseoso al estado sólido. Por ejemplo, el hielo al enfriarse da como resultado la transformación al estado sólido (hielo).
Congelación
Las partículas en estado líquido de un solvente están débilmente acopladas entre sí. Este es un indicador de las débiles fuerzas de atracción entre las partículas que del estado sólido. La congelación es un estado de líquido en el que la temperatura del sistema desciende por debajo del punto de congelación del sólido. Por lo tanto, es una transición de fase donde un líquido se convierte en un estado sólido. En resumen, la congelación es el cambio de fase de solidificación del contenido líquido de una sustancia, que ocurre principalmente debido al enfriamiento de una sustancia.
La congelación es una reacción exotérmica, es decir, el calor se libera durante el proceso de congelación. La congelación también se conoce como solidificación.
Ejemplos de congelación:
- Congelador
- Anticongelante
- Alimentos congelados
- Nevada
- Copos de nieve
- Hielo marino
¿Por qué se produce la congelación?
La congelación de un sólido ocurre cuando la energía térmica transferida a las moléculas del sistema durante el proceso de conversión del estado sólido al líquido es comparativamente mayor que su energía potencial que mantiene unidas las partículas en forma de una red cristalina de un sólido. Esta energía potencial de la sustancia indica la energía de red del sólido.
Cuando disminuimos la temperatura de una sustancia, el calor se libera del sistema. Esto da como resultado la extracción de calor y la reducción de la presión. Las partículas que forman la sustancia pierden su energía cinética y se aproximan más. Esto es seguido además por el aumento en la energía potencial del sistema. El sistema alcanza lentamente un estado estable. Por lo tanto, se produce la conversión a sólido.
Punto de congelación
El punto de congelación de una sustancia es la temperatura a la que un líquido pasa a estado sólido. Todos los líquidos poseen una característica en la que se congelan y se transforman al estado sólido. El aumento de presión aumenta los puntos de congelación. Las mezclas y compuestos orgánicos poseen un punto de congelación más bajo en comparación con el punto de fusión.
Diferentes líquidos tienen diferentes puntos de congelación como se ilustra en la siguiente tabla:
| Solvente | Fórmula | Punto de congelación (°C) |
| Agua | H2O _ _ | 0.0 |
| Ácido acético | CH3COOH _ _ | 17.0 |
| Benceno | C 6 H 6 | 5.5 |
| Cloroformo | CHCl 3 | -63.5 |
| Etanol | C2H5OH _ _ _ _ | -114.7 |
| Fenol | C 6 H 5 OH | 43.0 |
Factores que afectan el punto de congelación de un Líquido
Los diversos factores que afectan el punto de congelación de un líquido son los siguientes:
- Tipos de moléculas
Las partículas que forman un líquido afectan el punto de congelación del líquido. Las fuerzas de atracción intermoleculares son directamente proporcionales al punto de congelación. Por ejemplo, las fuerzas de atracción intermoleculares entre las moléculas del líquido son débiles, por lo tanto, su punto de congelación es bajo. - Presión
Cuando la presión de una sustancia desciende por debajo de 1 atm, se produce la congelación. Sin embargo, en el caso del agua, cuanto mayor es la presión, menor es el punto de congelación, es decir, son inversamente proporcionales entre sí. - Tipos de cambios
Los cambios físicos y químicos afectan el punto de congelación de una sustancia. Por ejemplo, el punto de congelación de un solvente disminuye al mezclarlo con otra sustancia soluble. Este es un cambio químico. Del mismo modo, la alteración de la presión reduce el punto de congelación.
Calor de fusión
El calor se extrae del líquido contenido en el sistema para congelarlo. Algunos de los líquidos se pueden sobreenfriar, es decir, estos líquidos se pueden enfriar por debajo del punto de congelación. Este es el estado en el que no se forman cristales sólidos. Cuando colocamos un cristal semilla en un líquido sobreenfriado, se inicia y desenstring la congelación. Cuando se libera el calor de fusión, la temperatura sube rápidamente hasta el punto de congelación.
Líquido sobreenfriado
El superenfriamiento es el proceso de enfriar el líquido, más allá de su punto de congelación, de modo que el líquido no cambie al estado sólido. Es la fase en la que el líquido no solidifica ni siquiera al someterlo a un punto más allá de su punto de congelación. Para la mayoría de las sustancias, los puntos de congelación y fusión de una sustancia son equivalentes. Ciertas sustancias se enfrían más allá de su punto de congelación mientras conservan su fase líquida. Estos se denominan líquidos sobreenfriados.
Ejemplos: las nubes en altitudes elevadas son una colección de gotas de agua superenfriadas, todas colaboradas por debajo de su punto de congelación.
Ejemplos de preguntas
Pregunta 1: ¿Diferenciar entre el punto de congelación y el punto de fusión?
Responder:
| Punto de congelación | Punto de fusion | |
| Definición | La temperatura a la que un líquido cambia su estado a sólido. | La temperatura a la cual el sólido cambia al estado líquido. |
| Pureza del producto final | Similar al punto de fusión de la misma sustancia, sin embargo, puede variar ligeramente | Similar al punto de congelación de la misma sustancia, sin embargo, puede variar ligeramente |
| entropía | Disminuye | aumenta |
Pregunta 2: ¿Qué elementos tienen el punto de congelación más alto?
Responder:
El punto de congelación más alto es del elemento Tungsteno con la tasa de fusión más alta, correspondiente a 3695 K.
Pregunta 3: Un recipiente de vidrio que contiene hielo tiene gotitas de agua acumuladas en la superficie exterior. Explique.
Responder:
El agua fría contenida en un recipiente de vidrio se enfría. El vapor de agua contenido en el aire entra en contacto con la pared del recipiente de vidrio. Debido a la baja temperatura del vapor, el líquido se forma en forma de gotas de agua en la superficie exterior. Este proceso se conoce como condensación.
Pregunta 4: ¿Qué es la depresión del punto de congelación?
Responder:
La depresión del punto de congelación se denomina disminución de la temperatura a la que se congela una sustancia, lo que ocurre cuando se agrega al sistema una cantidad menor de otra sustancia no volátil. Este concepto se puede visualizar fácilmente en la vida diaria, como agregar sal al agua (que se usa en las máquinas para hacer helados y para descongelar las carreteras), mezclar dos impurezas en una droga finamente pulverizada o alcohol en agua.
Pregunta 5: Explique por qué el agua en forma de hielo tiene un efecto refrescante, mientras que el agua en forma de vapor puede causar quemaduras graves.
Responder:
En el estado sólido del hielo, las moléculas de agua poseen poca energía, mientras que en el caso del vapor, las moléculas de agua poseen mucha energía. La alta energía del vapor de agua en forma de vapor se transfiere al cuerpo y puede causar quemaduras, mientras que, en el caso del hielo, la reacción es exotérmica, donde las moléculas de agua toman energía del cuerpo y, por lo tanto, un efecto de enfriamiento. es sentido.
Pregunta 6: Formular para la depresión del punto de congelación y sus ejemplos.
Responder:
Depresión del punto de congelación = ΔT F = K F × b × i
dónde,
ΔT F = depresión del punto de congelación
K F = constante crioscópica
b = molalidad
i = factor de van’t Hoff.
Ejemplos:
- Salado de caminos helados.
- Anticongelante natural: supervivencia en climas fríos.
- Líquidos de radiadores en Automóviles.
Pregunta 7: ¿Diferenciar entre el punto de congelación y el punto de ebullición?
Responder:
Punto de ebullición:
- La temperatura a la que la presión de vapor de un líquido se considera equivalente a la presión que rodea al líquido donde se convierte en vapor.
- Diferentes líquidos poseen diferentes puntos de ebullición en función de su «presión ambiental».
- Por ejemplo, la BP del ‘agua’ es 100 o C
Punto de congelación:
- La temperatura a la que una sustancia sufre la transformación de líquido a sólido.
- El punto de congelación y la presión son directamente proporcionales entre sí.
- Por ejemplo, el punto de congelación del agua es 0 o C
Publicación traducida automáticamente
Artículo escrito por mallikagupta90 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA