James Chadwick, un físico inglés, descubrió el neutrón en 1932. Muchos investigadores de todo el mundo estaban examinando las propiedades e interacciones de la partícula solo unos años después de su descubrimiento. Cuando golpean con neutrones, muchos elementos sufren fisión, una especie de proceso nuclear en el que el núcleo del material pesado se divide en dos fragmentos más pequeños casi iguales. Cada núcleo fisionado emite neutrones libres adicionales, así como los unidos a las piezas de fisión, durante esta reacción.
Bajo la dirección del científico Enrico Fermi, un grupo de investigadores estadounidenses demostró en 1942 que se crean suficientes neutrones libres durante el proceso de fisión para sostener una reacción en string. Este avance allanó el camino para el desarrollo de la bomba atómica. A raíz de los avances tecnológicos, la energía nuclear se utilizó para producir enormes cantidades de energía eléctrica a gran escala. La capacidad de fabricar grandes cantidades de isótopos radiactivos útiles para una serie de propósitos ha sido posible gracias a la absorción de neutrones por núcleos sujetos a las altas intensidades de neutrones disponibles en los reactores nucleares. Además, el neutrón se ha convertido en un instrumento crucial en la investigación pura.
Comprender la estructura de la materia requiere el conocimiento de sus propiedades y estructura. Las reacciones nucleares inducidas por neutrones proporcionan información crucial sobre el núcleo atómico y la fuerza que lo mantiene unido.
¿Qué es un neutrón?
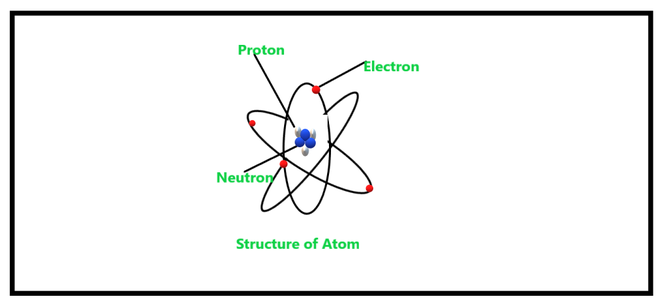
Los neutrones son partículas subatómicas que son uno de los constituyentes principales de los núcleos atómicos dentro de los electrones y protones. Neutrón, partícula subatómica neutra que es un constituyente de todos los núcleos atómicos excepto el hidrógeno ordinario.
Los neutrones y los protones se denominan juntos nucleones, ya que se comportan de manera muy similar dentro de los núcleos de los átomos. La masa de un nucleón se puede aproximar aproximadamente a al menos una unidad de masa (a menudo abreviada como amu). La rama de la ciencia que se ocupa del estudio de las propiedades de los neutrones y también de las interacciones de esas partículas subatómicas con diferente materia y radiación no particulada se denomina física atómica.
Un neutrón está presente dentro del núcleo de un átomo, el átomo de hidrógeno no contiene un núcleo. Al igual que los protones y los neutrones, ambos están presentes dentro del núcleo y se conocen en conjunto como nucleones.
Descubrimiento de neutrones
La existencia de neutrones se observó con la ayuda del modelo atómico nuclear de Rutherford. hay algunos puntos señalados en el descubrimiento de neutrones. (También nos da información notable de la disposición de las partículas constituyentes)
- En este experimento donde la mayor parte de la partícula alfa pasa sin reflejarse.
- algunos de ellos se desvían en ángulos menores y otros con un ángulo mayor a 180 grados.
- Así indicaba la presencia de una partícula en la parte media del átomo, es decir, el núcleo; marcó la presencia de una partícula de masa y el neutrón fue descubierto más tarde en 1932 por James Chadwick.

Descubrimiento de neutrones
Como los electrones tienen una masa insignificante y esto significa que la masa de un átomo solo se debe al protón, pero crearía problemas en el modelo, por lo que se indicó la presencia de alguna partícula neutra con un protón que tiene la misma masa que la de un protón. estar presente en el átomo. Rutherford se dio cuenta de que la masa atómica de diferentes especies no se puede determinar a menos que exista la presencia de otra partícula, por lo tanto, Rutherford en 1920 afirmó que hay un tipo de partícula neutra con una masa igual a la masa del protón presente. James Chadwick, en 1932 durante el estudio de la transmutación artificial de los átomos, descubrió una partícula indicada por Rutherford en 1920. Cuando una partícula alfa que se mueve rápidamente es bombardeada con una fina lámina de berilio, el berilio se transforma en carbono y emite una partícula neutra de la misma masa que el protón.
Carga y masa del neutrón
- Un neutrón no tiene carga eléctrica ligada a él. Como resultado, los neutrones son partículas subatómicas con carga neutra.
- La masa de un neutrón es de aproximadamente 1,008 unidades de masa atómica. La masa de un neutrón es de aproximadamente 1,674 × 10 -27 kg cuando se mide en kilogramos.
- Debido a que los neutrones no tienen carga eléctrica, la espectrometría de masas no se puede utilizar para estimar su masa directamente.
- Al restar la masa de un protón de la masa de un núcleo de deuterio (el deuterio es un isótopo de hidrógeno con un protón, un electrón y un neutrón en su estructura atómica), se puede calcular la masa del neutrón.
Debido a que la masa del electrón es tan pequeña en comparación con la del protón y el neutrón, la masa del neutrón se puede estimar restando la masa del protón de la masa del átomo de deuterio.
Características del neutrón
- El momento magnético de los neutrones no es igual a cero, a pesar de que se consideran partículas neutras. A pesar de que los campos eléctricos no tienen efecto sobre los neutrones, los campos magnéticos sí tienen influencia sobre estas partículas subatómicas.
- Los neutrones tienen mucha penetración, aunque no tanta como los rayos cósmicos. Todavía no han podido ionizar un gas.
- La masa aproximada de un átomo en amu es igual a la suma total del neutrón y el protón presentes en un átomo (unidad de masa atómica). Su masa se calcula restando la masa del protón de la masa atómica.
- El campo magnético afecta a estas partículas subatómicas, mientras que un campo eléctrico no tiene influencia sobre ellas. Su campo magnético está ligado a la subestructura de los quarks ya la distribución interna de la carga.
- El neutrón está formado por tres quarks, que son las partículas fundamentales que le dan al neutrón sus propiedades magnéticas.
La siguiente tabla muestra las otras características importantes relacionadas con los neutrones como:
| Símbolo |
norte |
| Naturaleza |
Neutral |
| Masa relativa |
Igual al átomo de H |
| Masa real |
1,6 × 10 -27 kg |
La representación de los átomos en términos de su masa atómica y número atómico se puede hacer como:
Aplicaciones de los neutrones
- Los neutrones son partículas altamente ionizadas y penetrantes que se pueden emplear en la terapia de captura de boro y en aplicaciones médicas. Sin embargo, cuando se absorben, activan la sustancia y la vuelven radiactiva.
- Es importante en las reacciones nucleares (la comprensión del comportamiento de los neutrones, en particular, ha ayudado en la creación de armas y reactores nucleares).
- El método de análisis de activación de neutrones (NAA) se usa para estudiar una muestra simple de materiales en un reactor nuclear, y el emisor de neutrones se usa para localizar núcleos ligeros en el medio ambiente.
- Se utiliza en tomografía de neutrones médica, pero tiene efectos secundarios desfavorables que dejan el área afectada radiactiva, por lo que no se emplea con frecuencia. La lente de neutrones se estaba desarrollando en ese momento.
- Se utiliza en el tratamiento de captura de boro, que utiliza un pequeño haz de neutrones para tratar el cáncer. La energía entregada a las regiones malignas por la radiación de neutrones es órdenes de magnitud mayor que la entregada por la radiación gamma.
- El uranio-235 y el plutonio-239 se utilizan prácticamente siempre en los reactores de fisión nuclear debido a la absorción del núcleo.
- Las aplicaciones de neutrones cálidos, calientes y fríos se emplean en instalaciones de dispersión nuclear donde la radiación se utiliza para condensar materia en estudios de rayos X.
Problemas de muestra
Problema 1: Defina el término Nucleón.
Solución:
Tanto los protones como los neutrones están presentes dentro del núcleo, se conocen en conjunto como nucleones.
Problema 2: Calcular el número de neutrones en el átomo de sodio.
Solución:
El número atómico del sodio (Na) es 11.
El numero masico del sodio es 23
Por lo tanto, usando la fórmula:
No. de neutrones = Masa atómica − número atómico
= 23-11
= 12
Problema 3: ¿Cuál es la masa atómica del nitrógeno?
Solución:
Sea la masa atómica del nitrógeno a.
Entonces por la fórmula:
No. de neutrones = Masa atómica − número atómico
7 = un – 7
un = 14
Por lo tanto, la masa atómica del nitrógeno es 14.
Problema 4: Si los átomos contienen partículas cargadas, ¿por qué no tienen carga?
Solución:
Contienen el mismo número de protones que de electrones, lo que los hace neutros.
Problema 5: ¿Cuántos neutrones tiene el carbono?
Solución:
El número atómico del Carbono (C) es 6.
El número de masa del carbono es 12.
Entonces por la fórmula:
No. de neutrones = Masa atómica − número atómico
= 12 – 6
= 6
Publicación traducida automáticamente
Artículo escrito por chauhanishan82 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA