En sus actividades diarias, notará que si el hielo se calienta, se convierte en agua. Si el agua se calienta, se convierte en vapor. Si el vapor se enfría, se convierte en agua. Si el agua se enfría, se convierte en hielo. Este es un ejemplo de la vida diaria donde todos vemos la aplicación del cambio en el estado de la cuestión, pero alguna vez pensaste ¿Cómo es posible? ¿Cómo se produce esta transformación? ¿Y de qué depende todo? No se preocupe, obtendrá respuestas a todas sus preguntas en este artículo.
Cambio de estado de la materia
El estado sólido, el estado líquido y el estado gaseoso son tres estados de la materia, y cualquier cambio físico en su estado se denomina cambio de estado de la materia. Estos cambios son de naturaleza reversible, lo que significa que pueden alcanzar cualquier estado una y otra vez. Esta propiedad reversible de los tres estados depende de diferentes parámetros y condiciones que se discutirán a continuación.
Un cambio físico en una materia se denomina cambio de estado de la materia. Son modificaciones reversibles que no requieren cambios en la composición química de la materia. La fusión, la congelación, la sublimación, la deposición, la condensación y la vaporización son ejemplos de transiciones de estado comunes.
Podemos entender el significado de un cambio de estado de la materia de una manera más, es decir, cuando un sólido se calienta, se convierte en líquido, y cuando un líquido se calienta, se convierte en gas, y cuando un gas se enfría, se convierte en líquido. cuando un líquido se enfría cambia a sólido. Y, podemos intercambiar estos estados por:
- Cambiar la temperatura
- Cambiando la presión
¿Por qué cambian los estados de la materia?
El cambio de estado se produce debido a los siguientes factores:
- El cambio en el espacio intermolecular y la fuerza de atracción,
- El cambio de temperatura,
- El cambio de presión y
- El cambio en la energía cinética de la partícula.
Analicemos cada punto con más profundidad a medida que
1. Al cambiar la temperatura: el efecto de la temperatura sobre el calentamiento de una materia depende de la naturaleza de la materia y de las condiciones requeridas para provocar el cambio. Entonces, analicemos ahora los 6 intercambios entre estos estados.
- Cambio de sólido a líquido: este proceso se conoce como fusión . El proceso en el que una sustancia sólida cambia a líquido al calentarla se llama fusión. Al aumentar la temperatura del sólido, la energía cinética de la partícula aumenta y vence la fuerza de atracción entre las partículas, por lo que el sólido se funde y se convierte en líquido.
- Cambio de líquido a gas: este proceso se conoce como ebullición o vaporización . El proceso en el que un líquido se convierte rápidamente en gas al calentarlo se llama ebullición. La temperatura a la cual un líquido hierve y cambia rápidamente a gas a presión atmosférica se llama punto de ebullición del líquido.
- Cambio de gas a líquido: este proceso se conoce como condensación . El proceso de convertir gas en líquido por enfriamiento se llama condensación. La condensación es lo contrario de la ebullición.
- Cambio de líquido a sólido: este proceso se conoce como congelación . El proceso de transformación de líquido en sólido por enfriamiento se llama congelación. Congelar significa solidificación. Es el proceso inverso al de fusión.
- Cambio de sólido a gas: este proceso se conoce como sublimación . El cambio de sólido directamente a vapor al calentarse sin pasar por el estado líquido intermedio se llama sublimación. Las sustancias comunes que sufren sublimación son el cloruro de amonio, el yodo, el alcanfor, la naftalina y el antraceno. por ejemplo, el dirust de carbono sólido (o hielo seco) se sublima para formar gas de dirust de carbono. Las bolas de naftalina desaparecen con el tiempo sin dejar ningún residuo.
- Cambio de gas a sólido: este proceso se conoce como deposición o desublimación . Es un proceso termodinámico en el que el gas cambia a sólido directamente sin entrar en la fase líquida.
2. Cambiando la presión: El estado físico de la materia también se puede cambiar cambiando la presión. Al aplicar alta presión, las partículas de un gas pueden juntarse, lo que significa que los gases pueden licuarse fácilmente aplicando presión y reduciendo la temperatura. Cuando se aplica presión, las partículas se juntan, por lo que aumenta la fuerza de atracción y disminuye el espacio intermolecular. Por lo tanto, el gas se licua. Cuando se reduce la presión alrededor del dirust de carbono sólido, su temperatura aumenta y se transforma directamente en gas de dirust de carbono.
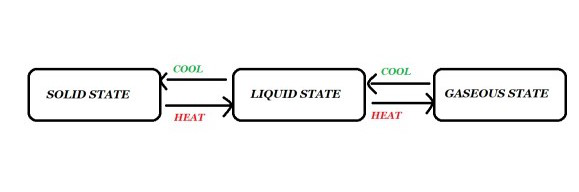
Interconversión de tres estados de la materia
Los estados de la materia son interconvertibles. El estado de la materia se puede cambiar cambiando la temperatura o la presión. La transición de un estado a otro se denomina interconversión de la materia. Es un proceso en el que la materia pasa de un estado a otro y luego vuelve a su estado original sin cambios en su composición química. El calentamiento puede transformar sólidos en líquidos. Estos cambios se muestran en la figura que se muestra a continuación.

Interconversión de tres estados de la materia
Definición importante relacionada con el cambio de estado de la materia
- Punto de fusión: La temperatura a la que un sólido se funde para formar un líquido a presión atmosférica se denomina punto de fusión. Durante el derretimiento, la temperatura del hielo no aumenta aunque el calor se suministre continuamente debido al calor latente de fusión, este calor latente se usa para vencer la fuerza de atracción entre las partículas de hielo.
- Punto de ebullición: La temperatura a la que un líquido hierve para formar vapores a presión atmosférica se denomina punto de ebullición. El punto de ebullición del agua es de 373 k.
- Calor latente: La energía térmica que debe suministrarse para cambiar el estado de una sustancia se denomina calor latente. Se llama calor latente porque se vuelve/se oculta en el estado cambiante de la sustancia y no muestra su presencia al elevar la temperatura. El calor latente que aportamos se consume en vencer las fuerzas de atracción entre las partículas de una sustancia durante el cambio de estado. El calor latente es de dos tipos: el calor latente de fusión y el calor latente de vaporización.
- Calor latente de fusión (cambio de sólido a líquido): El calor latente de fusión (o fusión) de un sólido a líquido es la cantidad de calor en julios necesarios para convertir 1 kilogramo de sólido (en su punto de fusión) a líquido sin ninguna cambio de temperatura
- Calor latente de vaporización (cambio de líquido a gas): durante la ebullición, la temperatura del agua no es la correcta, incluso cuando se suministra calor continuamente, ya que este calor de vaporización se usa para vencer la fuerza de atracción entre las partículas de agua.
- Punto de congelación: La congelación es la transformación del agua líquida en hielo sólido. El punto de congelación es la temperatura a la que sucede.
- Punto de ebullición: El proceso por el cual un líquido hierve y se transforma en gas se conoce como vaporización. El punto de ebullición de un líquido es la temperatura a la que comienza a hervir.
- Condensación: el espejo tiende a empañarse cuando te duchas con agua caliente en un baño cerrado. Usted se estará preguntando por qué ocurre esto. Cuando el agua caliente de la ducha se evapora, se enfría y pierde energía al entrar en contacto con superficies más frías como el espejo. Las partículas de agua más frías carecen de energía para vencer las fuerzas de atracción entre ellas. Se combinan para crear gotas de agua líquida. La condensación es el proceso mediante el cual el gas se transforma en líquido.
- Vaporización: Si el agua se calienta lo suficiente, comienza a hervir. Se desarrollan burbujas de vapor de agua en el agua hirviendo. Esto ocurre cuando las partículas de agua líquida reúnen suficiente energía para superar totalmente la fuerza de atracción entre ellas y pasar a la forma gaseosa. Las burbujas suben por el agua y salen como vapor de la cacerola. El proceso por el cual un líquido hierve y se transforma en gas se conoce como vaporización. El punto de ebullición de un líquido es la temperatura a la que comienza a hervir.
- Sublimación: La sublimación es el proceso mediante el cual los sólidos se transforman inmediatamente en gases. Cuando los sólidos absorben suficiente energía para vencer totalmente las fuerzas de atracción entre ellos, esto sucede. El hielo seco es un ejemplo de sólidos que se subliman.
- Evaporación: El cambio de un líquido a vapor a cualquier temperatura por debajo de su punto de ebullición se llama evaporación. Es un fenómeno superficial en el que las partículas de la superficie obtienen suficiente energía para vencer las fuerzas de atracción. Esta operación provoca el enfriamiento porque cuando un líquido se evapora, las partículas del líquido absorben calor del entorno y su entorno se enfría. Las partículas en la superficie de un líquido tienen mayor energía cinética que otras, por lo que rompen las fuerzas de atracción entre la partícula y escapan de la superficie del líquido en forma de vapores.
Problemas de muestra
Problema 1: ¿Por qué usamos ropa de algodón en verano?
Solución:
Debemos usar ropa de algodón en verano para mantenernos frescos y cómodos, ya que el algodón es un buen absorbente de agua, por lo que absorbe el sudor del cuerpo y lo expone al aire para que se evapore. Por lo tanto, refresca nuestro cuerpo.
Problema 2: ¿Por qué el CO 2 sólido se conoce como hielo seco?
Solución:
El CO 2 sólido se convierte directamente al estado gaseoso al disminuir la presión a 1 atm sin llegar al estado líquido, por eso también se le conoce como hielo seco. Además, debido a esto, se coloca o almacena a alta presión.
Problema 3: ¿Por qué la evaporación siempre provoca enfriamiento?
Solución:
El enfriamiento causado por la evaporación se basa en que cuando el líquido se evapora toma calor latente de vaporización del entorno, que al perder calor se enfría.
Problema 4: ¿Por qué nos sentimos fríos cuando nos aplicamos acetona en las palmas de las manos?
Solución:
Cuando ponemos acetona en nuestra mano, se evapora al tomar calor de nuestra mano y nuestra mano se siente fría.
Problema 5: ¿Por qué los gases se pueden comprimir fácilmente pero los líquidos no?
Solución:
Esto se debe a que las partículas de gas tienen un gran espacio intermolecular entre ellas, por lo que tienden a comprimirse, pero los líquidos ya tienen menos espacio intermolecular, por lo que no se pueden comprimir más.
Problema 6: ¿Cómo afecta la humedad al proceso de evaporación?
Solución:
Cuando la humedad del aire es baja, la tasa de evaporación aumenta. Por lo tanto, más humedad denota menos evaporación.
Publicación traducida automáticamente
Artículo escrito por kavyagupta0098 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA