Los gases inertes son químicamente no reactivos. Los gases nobles, también denominados gases inertes, son elementos del grupo 0. Hay seis tipos de gases nobles, helio (He), neón (Ne), argón (Ar), criptón (Kr), xenón (Xe) y radón radiactivo (Rn). Los gases nobles son el tipo de elementos pertenecientes al grupo 18. En condiciones estándar de temperatura y presión, todos los gases inertes existen en estado gaseoso de la materia.
Propiedades de los gases nobles
- Los gases nobles son gases monoatómicos iNoderos, no inflamables, incoloros y con una reactividad química insignificante.
- Baja reactividad química
- No inflamable en condiciones normales.
- Bajas densidades
- Todos los gases nobles conducen electricidad y fluorescencia, lo que puede ser útil en una variedad de situaciones para mantener una atmósfera estable y segura.
- En el agua, todos los gases nobles son insolubles.
- Debido a que tienen un octeto completo, son bastante estables. Como resultado de su menor potencial para ganar o perder electrones, rara vez reaccionan con otros elementos para crear enlaces químicos. Sin embargo, siempre hay excepciones. En esta situación, Xe es una excepción. El xenón es un gas noble que puede combinarse con fluoruro u rust para producir compuestos.
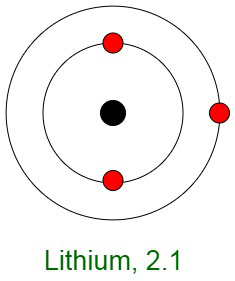
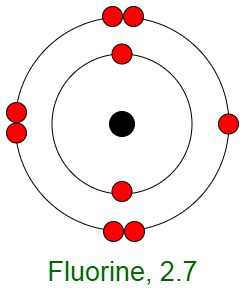
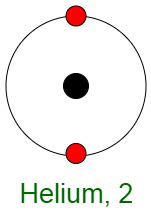
Inercia de los gases nobles
Los gases nobles son en su mayoría no reactivos, además de estar sujetos a condiciones extremas particulares. Por lo tanto, son adecuados para su colocación en aplicaciones para evitar reacciones no deseadas. El hidrógeno y el helio son compuestos neutros que no forman enlaces químicos. Ciertos otros compuestos como el xenón, el criptón y el argón muestran poca reactividad.
La reactividad de los gases nobles sigue el orden:
Ne < He < Ar < Kr < Xe < Rn ≪ Og
Los gases nobles muestran indiferencia hacia el compuesto químico oxígeno, por ejemplo, confiere total no inflamabilidad a los gases nobles.
¿Por qué los gases nobles son inertes?
Cuando los elementos reaccionan, sus átomos completan sus capas externas al perder, ganar o compartir electrones. La razón principal de la inercia de los gases nobles es la configuración electrónica estable de sus átomos. Esto implica que los átomos de los gases nobles están completos con respecto a sus capas exteriores, también conocidas como capas de valencia. No muestran ninguna tendencia a intercambiar, es decir, ganar o perder electrones. Los gases nobles no forman compuestos fácilmente y no participan en reacciones químicas. Por lo tanto, se presentan principalmente en forma de gases monoatómicos.
En otras palabras, tienen configuraciones orbitales externas completamente llenas debido a que poseen energía mínima. Por lo tanto, se dice que los gases inertes poseen una configuración electrónica completa.
Aplicaciones de Gases Inertes
- Uso de argón en lámparas incandescentes para evitar que el filamento de tungsteno caliente se oxide.
- Uso de helio como gas de respiración por parte de buzos de aguas profundas para prevenir la toxicidad del oxígeno, el nitrógeno y el dirust de carbono (hipercapnia).
- Uso de helio como gas de elevación en globos de fiesta y dirigibles.
- Los gases nobles se emplean para crear atmósferas inertes, principalmente para la soldadura por arco.
- Para salvaguardar los especímenes,
- Para evitar reacciones químicas.
- Hay luces de neón y otra aplicación son los faros de criptón.
- También se utiliza en láseres.
- También se puede utilizar para enfriar imanes superconductores.
Ejemplos de preguntas
Pregunta 1: ¿Por qué se utiliza el argón como ‘gas de protección’?
Responder:
El argón se utiliza como «gas de protección» al soldar piezas de metal. Esto se debe a que el argón es de naturaleza inerte, por lo tanto, el metal caliente no se oxida y estropea la soldadura. Además, se evita que el aire llegue al metal.
Pregunta 2: ¿Dónde se usa el hidrógeno principalmente debido a la inercia?
Responder:
El hidrógeno es lo suficientemente inerte para usarse en cromatografía, para la separación de componentes de la mezcla.
Pregunta 3: ¿Por qué las bombillas eléctricas se llenan de gases inertes y se sellan?
Responder:
Las bombillas eléctricas están llenas de gases nobles como el argón. Los gases inertes no reaccionan con el filamento de la bombilla. Esto evita la evaporación del filamento y mantiene la presión dentro de la bombilla. No se utiliza aire porque el filamento de la bombilla reaccionará con el oxígeno y se quemará debido a las altas temperaturas.
Pregunta 4: ¿Por qué el helio tiene una configuración 1s 2 mientras que todos los demás gases nobles tienen una configuración electrónica general ns 2 np 6 ?
Responder:
Todos los gases nobles, excepto el helio, tienen ocho electrones en su órbita más externa, por lo que su configuración electrónica general es ns 2 np 6 . El helio, en comparación, tiene dos electrones de valencia.
Pregunta 5: ¿Por qué el hierro no es un gas noble?
Responder:
El hierro no tiene electrones completos en su capa de valencia. Por lo tanto, reacciona con los elementos para formar compuestos, a diferencia de los gases nobles. Forma compuestos y logra una configuración estable.
Pregunta 6: Nombre algunos compuestos con los que reacciona el xenón y cuáles son los compuestos que se forman.
Responder:
El xenón reacciona con el flúor y el oxígeno para formar fluoruros y rusts, respectivamente. Algunos compuestos formados son difluoruro de xenón (XeF 2 ) y tetrrust de xenón (XeO 4 )
Pregunta 7: Dé reacciones de diferentes tipos de fluoruros formados con xenón.
Responder:
Xe + F2 → XeF2
Xe + 2F 2 → XeF 4
Xe + 3F 2 → XeF 6
Publicación traducida automáticamente
Artículo escrito por mallikagupta90 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA