La química orgánica es una rama de la ciencia que estudia la estructura, las propiedades y las interacciones de los compuestos orgánicos que tienen enlaces de carbono covalentes. Al examinar su estructura, se puede derivar su fórmula estructural. Para comprender mejor su comportamiento, se investigan las propiedades físicas y químicas, así como la reactividad química. El estudio de los procesos orgánicos incluye la síntesis química de productos naturales, productos farmacéuticos y polímeros, así como estudios de laboratorio y teóricos (in silico) de moléculas orgánicas individuales.
La química orgánica estudia los hidrocarburos (compuestos formados únicamente por carbono e hidrógeno) y los compuestos a base de carbono, pero también incluye otros elementos como el oxígeno, el nitrógeno, el azufre, el fósforo (presente en muchos productos bioquímicos) y los halógenos. El estudio de los compuestos que contienen elementos organometálicos se conoce como química organometálica.
Análisis Cualitativo de Compuestos Orgánicos
Una vez sintetizados los compuestos orgánicos en su forma más pura, se utiliza el análisis cualitativo para identificar su estructura y caracterización. El análisis proporciona información sobre los constituyentes que componen la sustancia química. El carbono, el hidrógeno, el oxígeno y el nitrógeno (en algunos casos) son los componentes más frecuentes que se encuentran en las moléculas orgánicas, por lo que se detectan mediante análisis. Ocasionalmente se encuentran y detectan azufre, halógenos, metales y fósforo mediante análisis cualitativos.
Detección de Carbono e Hidrógeno
Principio
El rust de cobre (II) seco o el rust cúprico se pueden utilizar para detectar carbono e hidrógeno en una molécula orgánica. En un tubo de vidrio duro, el compuesto orgánico se calienta con rust de cobre (II) seco. El carbono del compuesto se oxidará a dirust de carbono, mientras que el hidrógeno se oxidará a agua. Las siguientes son las reacciones:
C+ 2CuOΔ → CO2 + 2Cu
2H + 2CuOΔ → HO 2 + 2Cu
Por ejemplo, si la sustancia química orgánica bajo prueba tiene la fórmula molecular C x H y , entonces su combustión completa en presencia de rust cúprico se puede establecer como:
C x H y + (2x + y/2)CuOΔ → xCO 2 + y/2H 2 O + (2x + y/2)Cu
La capacidad del dirust de carbono para convertir el agua de cal en lechosa se puede utilizar para detectarlo (se forma carbonato de calcio). La capacidad del agua para condensarse en las secciones frías del tubo de ensayo se puede utilizar para identificarlo. El sulfato de cobre anhidro se vuelve ‘azul’ como resultado de esta reacción.
Ca(OH ) 2 + CO2 → CaCO3 + H2O
CuSO4 + 5H2O → CuSO4 ⋅ 5H2O _ _
Procedimiento
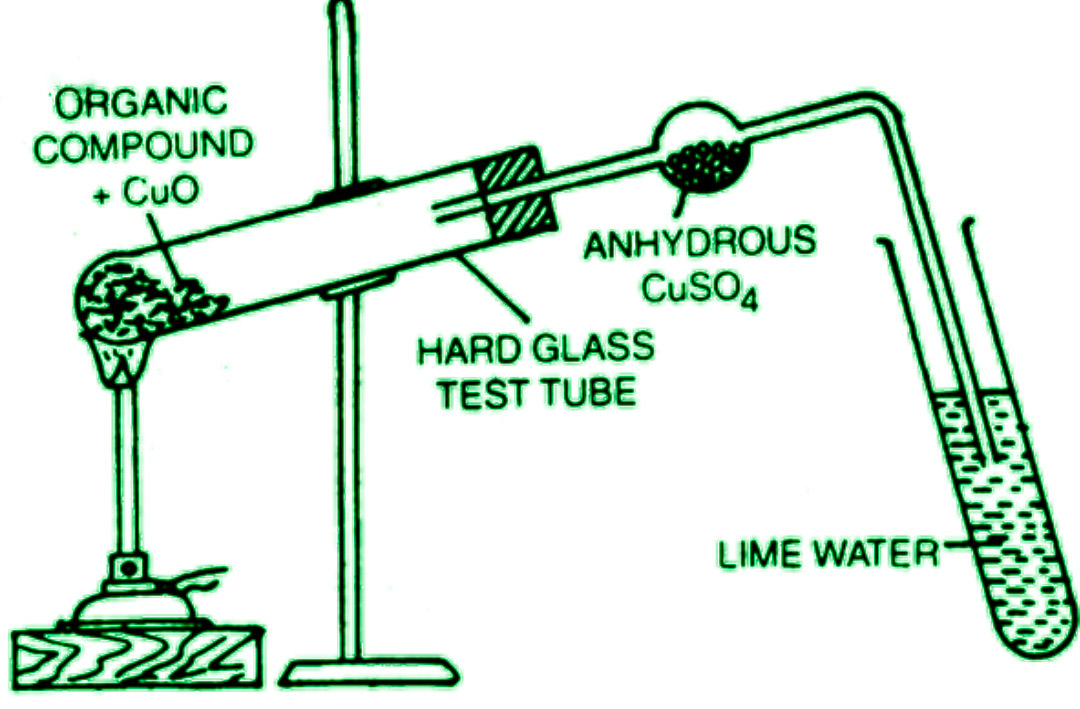
Una pequeña cantidad del componente orgánico seco y puro se mezcla con unas 5-6 veces el peso de polvo de rust cúprico puro y seco en el laboratorio. Luego, la combinación se calienta a una temperatura alta en un tubo de ensayo rígido con un tubo de suministro. El tubo de entrega tiene un bulbo en el medio y se sumerge en el agua de cal en el otro extremo, como se muestra.
Se colocan lana de vidrio y sulfato de cobre anhidro en el bulbo del tubo de suministro. Cuando el carbón se calienta, se oxida a dirust de carbono, volviendo lechosa el agua de cal. El sulfato de cobre anhidro en el bulbo se vuelve azul cuando el hidrógeno en el químico orgánico se oxida a agua, lo que indica su presencia.
Detección de Nitrógeno
El nitrógeno se encuentra en algunas moléculas orgánicas, como las aminas y los compuestos nitrogenados. Se utiliza un conjunto de experimentos para detectar nitrógeno en varias moléculas orgánicas, de la siguiente manera:
- Prueba de calentamiento en seco: Confirma la presencia de nitrógeno cuando el componente orgánico bajo examen se calienta intensamente y genera un olor a pelo quemado oa plumas. Sin embargo, la prueba tiene límites porque muchas sustancias que contienen nitrógeno no generan olor.
- Prueba de cal sodada: En un tubo de ensayo seco, una pequeña cantidad de sustancia orgánica se calienta vigorosamente con cal sodada (NaOH+CaO). La presencia de nitrógeno se indica si los vapores huelen a amoníaco.
NH 2 CONH 2 + 2NaOHCaO,Δ → 2NH 3 + Na 2 CO 3
Sin embargo, estos ensayos tienen limitaciones, ya que muchos compuestos orgánicos con grupos nitro y azo (–N=N–) no aparecen en esta prueba.
- Prueba de Lassaigne : La prueba de Lassaigne se utiliza para detectar nitrógeno, halógenos y azufre en un compuesto orgánico. Esta es una de las pruebas más fiables que se utilizan para detectar estos componentes. Los elementos presentes en los compuestos orgánicos se fusionan con sodio metálico para convertirlos de covalentes a su forma iónica.
- Preparación del extracto de Lassaigne: En un tubo de fusión, se calienta vigorosamente una pequeña cantidad de sodio hasta formar un glóbulo. El tubo se retira de la llama una vez que se ha formado el glóbulo, y se agrega una pequeña cantidad de sustancia química orgánica al tubo, que luego se calienta vigorosamente hasta que el tubo se pone al rojo vivo. Mientras tanto, prepara un plato chino con 10-15 mL de agua. Cuando el tubo se pone al rojo vivo, se sumerge en un plato de China lleno de agua y se filtra. El filtrado resultante se conoce como extracto de fusión de sodio o extracto de Lassaigne.
- Prueba del elemento nitrógeno: Debido a que el sodio en el extracto se combina con el exceso de agua para generar hidrrust de sodio, el extracto de fusión de sodio es alcalino. Para mantener la solución alcalina, a veces se agrega hidrrust de sodio. A esta solución alcalina de extracto de fusión de Sodio, se le añade un sulfato ferroso (FeSO 4 ) recién preparado. Luego, la mezcla se calienta ligeramente antes de enfriarse. Para acidificar la solución, se agrega una pequeña cantidad de ácido sulfúrico diluido. Si hay nitrógeno en la solución, se volverá verde o azul. La presencia de nitrógeno y azufre en el componente orgánico se indica cuando la solución se vuelve roja como la sangre.
Las reacciones para la prueba anterior son las siguientes:
Durante el proceso de fusión, el carbono y el nitrógeno del componente orgánico se combinan para generar cianuro de sodio, como se muestra:
Na + C+ N → NaCN
Cuando el ferrocianuro de sodio o el hexacianoferrato de sodio (II) se calientan con una solución de sulfato ferroso, algunos de los iones ferrosos o Fe 2+ se oxidan a iones férricos (Fe 3+ ). El azul de Prusia se produce cuando los iones férricos se combinan con hexacianoferrato de sodio (II) para producir hexacianoferrato (II) de hierro (II) o ferrocianuro férrico.
- 2NaCN + FeSO 4 → Na 2 SO 4 + Fe(CN) 2
- Fe(CN) 2 + 4NaCN → Na 4 [Fe(CN) 6 ] Hexacianoferrato de sodio (ii)
- 3Na 4 [Fe(CN)6] + 4Fe 3+ → Fe 4 [Fe(CN) 6 ] 3
Detección de halógenos
Los halógenos, si están presentes en el compuesto orgánico, pueden detectarse mediante las siguientes pruebas:
- Prueba de Beilstein: La prueba de Beilstein para detectar halógenos en compuestos orgánicos es un método simple, sensible y efectivo. Un alambre de cobre limpio y resistente se calienta en la llama no luminosa del mechero Bunsen hasta que se desvanece el color verde azulado o verdoso de la llama. Después de eso, el alambre se sumerge en el compuesto orgánico y se expone a la llama una vez más. La creación de haluros cúpricos y, por lo tanto, la presencia de halógeno en el compuesto, se indica cuando la llama se vuelve verde azulada o verde. Incluso moléculas como la urea y la tiourea, por ejemplo, muestran esta prueba debido a la creación de cianuro cúprico volátil, que tiene algunas restricciones. Tampoco dice qué tipo de halógenos están presentes en la sustancia química (bromo, cloro o yodo).
- Prueba de Lassaigne: Es un ensayo extremadamente preciso para detectar halógenos en compuestos orgánicos. La preparación del Extracto de Fusión de Sodio o Extracto de Lassaigne es la primera etapa. Los halógenos de los compuestos orgánicos se transforman en haluros de sodio de la siguiente forma:
Na + X → NaX
El siguiente paso es hervir una porción del extracto en ácido nítrico débil y luego colar la solución. Se le añaden unas gotas de solución de nitrato de plata y se ensayan los siguientes precipitados:
- El cloro se indica por la formación de un precipitado blanco que es soluble en amoníaco pero insoluble en HNO 3 diluido .
- La presencia de bromo se indica por la formación de un precipitado de color amarillo pálido que es algo soluble en amoníaco.
- La presencia de yodo se indica por la formación de un precipitado amarillo que es insoluble en amoníaco.
Detección de Azufre
El azufre, presente en un compuesto orgánico, se puede detectar mediante las siguientes pruebas:
- Prueba de Lassaigne: cuando un componente orgánico que contiene azufre se fusiona con sodio, el extracto resultante contiene sulfuro de sodio.
2Na + S → Na 2 S
La presencia de azufre en el producto químico se confirmará mediante las siguientes pruebas:
- Prueba de nitroprusiato de sodio: si una pequeña cantidad de extracto de fusión de sodio se trata con unas gotas de nitroprusiato de sodio, el compuesto se volverá violeta, lo que indica que contiene azufre. Estar quieto hace que el color violeta se desvanezca lentamente.
Na 2 S + Na 4 [Fe(CN) 5 (NO)] → Na 4 [Fe(CN) 5 (NOS)]
- Prueba de acetato de plomo: se agrega ácido acético diluido a la segunda mitad de la porción para acidificarla, seguido de unas gotas de acetato de plomo. La presencia de azufre en el compuesto orgánico se establece si se observa un precipitado oscuro que indica el desarrollo de sulfuro de plomo.
Na 2 S + (CH 3 COO) 2 Pb → PbS + 2CH 3 COONa
Detección de fósforo
Fusionando el compuesto orgánico con perrust de sodio, un agente oxidante, se puede determinar la presencia de fósforo en el componente orgánico. El fósforo del compuesto orgánico se oxida a fosfato de sodio.
5Na 2 O 2 + 2PΔ → 2Na 3 PO 4 + 2Na 2 O
Se usa agua para eliminar el material fundido y la solución acuosa resultante se calienta posteriormente con ácido nítrico fuerte. A esto se le añade molibdato de amonio. La presencia de fósforo se indica mediante un precipitado o color amarillo (debido a la producción de fosfomolibdato de amonio).
Detección de Oxígeno
Si bien no existen pruebas directas para detectar la presencia de oxígeno en una sustancia orgánica, los procedimientos enumerados a continuación pueden establecer su existencia indirectamente.
- La presencia de grupos funcionales o pruebas para confirmar la presencia de grupos funcionales como −OH, −COOH, −NO 2 , etc., indica indirectamente la presencia de oxígeno.
- Cuando la suma de los porcentajes de los componentes de una molécula orgánica determinada por análisis cuantitativo no es igual al 100 %, la suma diferencial indica la presencia de oxígeno y se puede calcular su proporción.
Problemas de muestra
Pregunta 1: ¿Qué es el análisis cualitativo de compuestos orgánicos y por qué es importante?
Responder
El análisis cualitativo de compuestos orgánicos es un análisis no cuantificable de compuestos orgánicos. Es significativo ya que proporciona una descripción detallada de los elementos que se encuentran en las moléculas orgánicas.
Pregunta 2: ¿Qué pasos se utilizan en el análisis cualitativo de compuestos orgánicos?
Responder
Para diferentes elementos como oxígeno, nitrógeno, carbono e hidrógeno, azufre, fósforo y halógenos, el análisis cualitativo emplea varios métodos de detección o pruebas. Cada una de estas pruebas tiene su propio conjunto de instrucciones a seguir y debe completarse de forma independiente.
Pregunta 3: ¿Qué método se utiliza para la detección de nitrógeno en un compuesto orgánico?
Responder
Se utilizan tres pruebas separadas para detectar nitrógeno: la prueba de calentamiento en seco, la prueba de cal sodada y la prueba de Lassaigne.
Pregunta 4: ¿Cómo podemos detectar la presencia de azufre en un compuesto orgánico?
Responder
El azufre se puede detectar utilizando extracto de Lassaigne y tratándolo con nitroprusiato de sodio o acetato de plomo y ácido acético para producir una coloración violeta o un precipitado o coloración amarillos.
Pregunta 5: ¿Cuáles son los tipos de análisis cualitativos?
Responder
Los constituyentes individuales en un complejo orgánico pueden detectarse a través del análisis cualitativo. Cada elemento tiene su propio conjunto de pruebas que se utilizan para validar que está presente en el complejo orgánico bajo examen.
Pregunta 6: ¿Cómo se detecta el oxígeno?
Responder
- La existencia de grupos funcionales o pruebas para validar la presencia de grupos funcionales (como OH, COOH, NO 2 , etc.) implica indirectamente la presencia de oxígeno.
- La suma diferencial revela la existencia de oxígeno, y se puede calcular su proporción, cuando los porcentajes totales de componentes en una molécula orgánica determinados por análisis cuantitativo no suman 100%.
Publicación traducida automáticamente
Artículo escrito por omkarsinghbaghel y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA