Las aminas son una clase importante de compuestos orgánicos. Se encuentran ampliamente en plantas y animales. Se encuentran entre proteínas, vitaminas, alcaloides, hormonas, etc. Los ejemplos sintéticos incluyen polímeros, fármacos, colorantes, etc. Estas aminas se utilizan ampliamente. Por ejemplo, la quinina es un fármaco antipalúdico importante, la adrenalina y la efedrina se usan para aumentar la presión arterial, la novocaína se usa como anestésico en odontología, la codeína se usa como analgésico (como analgésico). Benadryl se usa como un fármaco antihistamínico. Las sales de amonio cuaternario se utilizan como tensioactivos.
Las aminas se consideran derivados del amoníaco en los que uno, dos o los tres átomos de hidrógeno se reemplazan por un grupo alquilo o arilo.
Clasificación de las aminas
Las aminas se descomponen en primarias (1°), secundarias (2°) o terciarias (3°) porque uno, dos o tres hidrógenos de la molécula de amoníaco son desplazados por grupos alquilo o arilo en la molécula de amoníaco. Sin embargo, obtenemos RNH o ArNH 2 si un átomo de hidrógeno de amoníaco se reemplaza por un grupo alquilo (R) o arilo (Ar). Sin embargo, tomamos R-NH-R, que es la 2° amina, si los dos átomos de H del átomo de H amoniacal de RNH se reemplazan por otro grupo alquilo (R) o Ar. Y los grupos alquilo o arilo pueden ser iguales o diferentes.
El desplazamiento de los tres átomos de H del amoníaco o del otro H de R-NH-R por un grupo alquilo (primo alto) o arilo da Rn(primo) primo que puede ser 3° aminas (R”) iguales o desiguales. R o R’).
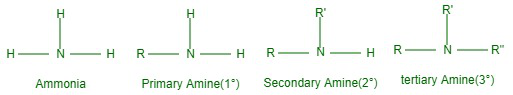
Los grupos característicos de las aminas primarias, secundarias y terciarias son amino, imino y terc-nitrógeno.
Además de estos tres tipos de aminas, existe otra clase de compuestos conocidos como libras de amonio cuaternario. Estos compuestos se pueden considerar como derivados de las sales de amonio en las que los cuatro átomos de H están retenidos por grupos alquilo o arilo. por ejemplo, yoduro de tetrametilamonio, cloruro de tetrametilamonio, hidrrust de tetrametilamoniometilamonio, bromuro de tetrametilamonio, etc.
Las aminas se pueden dividir en dos categorías:
- Aminas alifáticas: Las aminas en las que el átomo de nitrógeno está directamente unido a uno o más grupos alquilo se denominan aminas alifáticas. Por ejemplo, metilamina (1°), dimetilamina (2°) y trimetilamina (3°).
- Arilalquilaminas o aminas sustituidas de string lateral: las aminas en las que el átomo de nitrógeno está unido a una string lateral de un anillo aromático se denominan alquilaminas. por ejemplo, bencilamina (1°), dibencilamina (2°) y tribencilamina (3°).
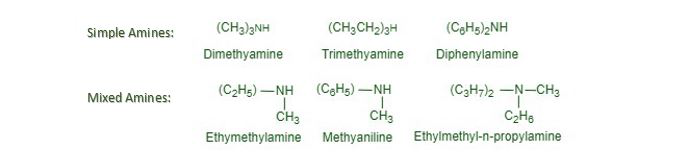
Aminas simples y mixtas. Las aminas secundarias y terciarias se pueden clasificar como aminas simples o mixtas según que todos los grupos alquilo o arilo unidos a los átomos de nitrógeno sean iguales o diferentes. Por ejemplo,
Propiedades físicas de las aminas
- Solubilidad: Las aminas alifáticas (1°, 2° y 3°) forman enlaces H con agua y, por lo tanto, son solubles en agua. Sin embargo, las aminas aromáticas son insolubles en agua debido en gran parte a los hidrocarburos.
- Puntos de ebullición : la amina 1 ° tiene un punto de ebullición más alto que la amina 3 ° debido a la presencia de dos átomos de H directamente unidos al N, lo que da como resultado un enlace de H más alto en la amina 1 °.
Carácter básico de las aminas
- Aminas alifáticas
- Todas las aminas alifáticas son más básicas que el amoníaco.
- En soluciones acuosas, la metilamina sigue el orden de basicidad (CH₂)₂NH > CH₂NH₂ > (CH₂), N (fe 2° 1 > 3º), pero para la etilamina y todas las demás aminas superiores, el orden de basicidad es R₂NH > R₂N > RNH. sigue. (es decir, 2° > 3° > 1°).
- El orden de basicidad en estado gaseoso es 3° > 2° > 1° aminas.
- Cuanto mayor sea el valor de Kp o menor sea el valor de pKb, más fuerte será la base.
- Aminas Aromáticas
- Todas las aminas aromáticas son bases más débiles que el amoníaco.
- Los grupos donantes de electrones como -CH 3 , – OCH 3, -NH 2 aumentan la basicidad mientras que las sustancias aceptoras de electrones como -NO 2 , -CN, -(halógenos) disminuyen la basicidad de la amina. El efecto de estas sustancias es más pronunciado en las condiciones p- que en las m-.
- Las anilinas o-sustituidas son bases más débiles que las anilinas, independientemente de la naturaleza de los sustituyentes que donan o retiran electrones. Esto se llama efecto orto y es causado por un impedimento estérico.
Las aminas alifáticas son más básicas que las aromáticas. Al igual que las aminas aromáticas, el par de electrones solitario presente en el nitrógeno participa en la resonancia y, por lo tanto, no está disponible para la donación, mientras que sí lo está en las aminas alifáticas.
Ejemplos de preguntas
Pregunta 1: Dar una prueba química para diferenciar entre etilamina y anilina.
Responder:
La etilamina es una amina alifática primaria, mientras que la anilina es una amina aromática primaria. Ambos pueden identificarse mediante la prueba de colorante azoico. Cuando la anilina se trata con HNO, (NaNO₂+ HCl diluido) a 273K, seguido de un tratamiento con una solución alcalina de 2-naftol, se obtiene el color naranja, pero debido a la formación de etilamina. Con gas N 2 da fuerte efervescencia de 1 alcohol.
Pregunta 2: Dar una prueba química para diferenciar entre anilina y N-metilamina.
Responder:
La anilina es una amina aromática primaria, mientras que la N-metilanilina es una amina aromática secundaria. Los dos se pueden separar por la reacción de carbilamina. Al mezclar CHCl 3 y KOH, la anilina desprenderá un olor desagradable debido a la formación de fenil carbilamina (isocianuro de fenilo), mientras que la N-metilanilina no reaccionará.
Pregunta 3: ¿Por qué la sustitución electrofílica ocurre más fácilmente en las aminas aromáticas que en el benceno?
Responder:
Debido al fuerte grupo activador -NH₂, los electrones en el átomo de N en la anilina se indican por encima del anillo de benceno. Como resultado, la densidad de electrones en el anillo de benceno aumenta en comparación con el benceno. Por lo tanto, la anilina se activa y la sustitución electrofílica ocurre más fácilmente en la anilina.
Pregunta 4: Dar una prueba química para diferenciar entre anilina y bencilamina.
Responder:
La anilina y la bencilamina se pueden separar mediante la prueba de colorante azoico. La anilina reacciona con NO 2 a 273-278 K para formar cloruro de benceno diazonio estable que da color naranja al reaccionar con una solución alcalina de β-naftol. Mientras que la bencilamina no da esta prueba.
Pregunta 5: la p-metoxianilina es una base más fuerte que la anilina, pero la p-nitroanilina es una base más débil que las aminas. Explique.
Responder:
El grupo metoxi (-OCH 3 ) es el grupo liberador de electrones y aumenta la densidad de electrones en el átomo de N. Por lo tanto, tiene tendencia a donar más electrones que la anilina y, por lo tanto, es una base más fuerte que la anilina. Por otro lado, el grupo nitro es el grupo atractor de electrones y, por lo tanto, la densidad de electrones en el átomo de nitrógeno disminuye. En consecuencia, la p-nitroanilina es una base más débil que la anilina.
Pregunta 6: ¿Podemos preparar anilina por la reacción de ftalimida de Gabriel?
Responder:
La reacción de la ftalimida de Gabriel a la anilina no se puede realizar porque requiere el tratamiento de la ftalimida de potasio con C 6 H 5 Cl o C 6 H 5 Br. Dado que los haluros de arilo no experimentan reacciones de sustitución nucleófila en condiciones normales, la reacción no se produce. Por lo tanto, la anilina no se puede preparar por este método.
Publicación traducida automáticamente
Artículo escrito por tanushree7252 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA