De niño, puede que hayas preparado suspensiones como barro y agua, harina y agua, o pintura al temple, que es una suspensión de colores sólidos en el agua. Estas suspensiones son mezclas heterogéneas de partículas visibles bastante grandes (o que se pueden ver con una lupa). Son turbios y, después de mezclar, las partículas suspendidas se asientan. Cuando formamos una solución, por otro lado, creamos una mezcla homogénea en la que no ocurre sedimentación y las especies disueltas son moléculas o iones. Las suspensiones se comportan de manera sustancialmente diferente a las soluciones. Una solución puede ser coloreada, pero es clara, las moléculas o iones son indetectables y no se sedimentan cuando se dejan reposar.
Los coloides (o dispersiones coloidales) son una clase de mezclas con características que se encuentran entre suspensiones y soluciones. Las partículas de un coloide son más grandes que las de la mayoría de las moléculas simples; sin embargo, las partículas coloidales son lo suficientemente pequeñas como para que no se asienten mientras están de pie.
coloides
Una solución en la que el tamaño de las partículas del soluto es intermedio entre las de la solución verdadera y la suspensión se denomina coloides . Simplemente, los coloides son mezclas en las que una sustancia se divide en partículas diminutas que se dispersan en una segunda sustancia. por ejemplo , solución de jabón, leche, sangre, etc. son algunos de los ejemplos de coloides.
Los coloides (también soluciones coloidales o sistemas coloidales) son mezclas de partículas insolubles distribuidas microscópicamente de un material que flota en otro. Las partículas suspendidas de un coloide pueden variar en tamaño de 1 a 1000 nanómetros (o 10 -9 metros).
Las partículas suspendidas en una combinación no deben asentarse para que se clasifiquen como coloides (de la misma manera que las partículas de las suspensiones se asientan en el fondo del recipiente si no se las altera). Se sabe que las soluciones coloidales muestran el efecto Tyndall, un fenómeno en el que los haces de luz que impactan en los coloides se dispersan como resultado de las interacciones entre la luz y el componente coloidal.
Tipos de coloides
Existen principalmente dos tipos de coloides que son:
- Coloides multimoleculares: cuando las moléculas más pequeñas de una sustancia o muchos átomos se disuelven y se combinan para formar una especie cuyo tamaño está en el rango del tamaño coloidal se conoce como coloides multimoleculares. por ejemplo, solución de azufre con miles de partículas S 8 .
- Coloides macromoleculares: los biomoleculares, como enzimas o proteínas, que tienen un tamaño más grande cuando se sumergen en una dispersión adecuada, se conocen como coloides macromoleculares. por ejemplo, caucho, celulosa, almidón, etc.
Preparación de soluciones coloidales
Los coloides que son estables se conocen como soles liófilos, en estos se dan fuertes fuerzas de atracción entre la fase dispersa y el medio de dispersión. Algunos de los principales métodos para preparar coloides son los siguientes:
(1) Método de condensación
Pequeñas partículas de soluto se condensan en este proceso para crear una partícula de fase dispersa.
- Por Oxidación: Podemos obtener azufre coloidal pasando oxígeno gaseoso a través de la solución de sulfuros de hidrógeno. HNO 3 , H 3 Br 2 , etc. se utilizan como agentes oxidantes en este proceso.
2H 2 S + O 2 ⇢ 2H 2 O + 2S
- Por Reducción: En el proceso se hacen reaccionar agentes reductores adecuados como formaldehído, perrust de hidrógeno, cloruro estannoso, etc. con la solución acuosa de estas sales para obtener metales como oro, plata y platino en estado coloidal.
2AuCl3 + 3SnCl2 ⇢ 3SnCl4 + 2Au
- Por Doble Descomposición: En este proceso se pasa sulfuro de hidrógeno por una solución fría de rust de arsénico en agua y se obtiene una solución de sulfuro de arsénico.
As 2 O 3 + 3H 2 S ⇢ As 2 S 3 + 3H 2 O (Solución de arsénico)
- Por Hidrólisis: Las soluciones salinas se hidrolizan hirviendo sus respectivas soluciones diluidas. Por ejemplo, el hidrrust férrico se obtiene por hidrólisis de su sal correspondiente.
FeCl 3 + 3H 2 O ⇢ Fe(OH) 3 + 3HCl (Solución coloidal de Hidrrust Férrico)
(2) Métodos de dispersión
Las partículas grandes de un material (suspensión) se descomponen en partículas más pequeñas utilizando estos procedimientos. Se utilizan los procedimientos que se enumeran a continuación:
- Dispersión mecánica: en este método, las sustancias se muelen en partículas gruesas y luego se mezclan con un medio de dispersión para obtener una suspensión. Luego, se muele en un molino coloidal que consta de dos tintes metálicos que giran en direcciones opuestas. Este método se utiliza para obtener soluciones coloidales de tinta negra, pinturas, barnices, tintes, etc.
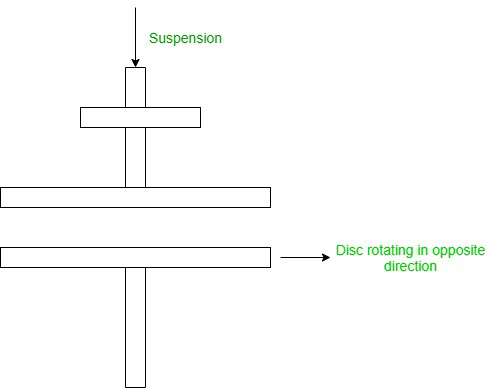
- Método eléctrico o de arco de Bredig: en este método, el metal que se va a convertir en solución se fabrica como dos electrodos que se sumergen en un medio de dispersión. Se utiliza un arco eléctrico entre los electrodos y el hielo para mantener frío el medio de dispersión. Aquí, la cantidad excesiva de calor da una sustancia de soluto coloidal.
- Peptización: El proceso de convertir un precipitado recién preparado en una solución coloidal se llama peptización. Se añade una pequeña cantidad de electrolito como agente de peptización. Algunos de los agentes peptizantes importantes son la gelatina de gemas de azúcar y electrolitos. Por ejemplo, un hidrrust férrico recién preparado se puede convertir en una solución coloidal a través de este método al agitarlo con agua que contiene FeCl 3.
Fe(OH) 3 + FeCl 3 → (Fe(OH) 1 Fe) +3 + 3Cl –
Propiedades físicas de soluciones coloidales
- Filtrabilidad: los coloides requieren filtros especializados conocidos como ultrafiltros para la filtración. Fluyen fácilmente a través de placas de filtro estándar sin dejar ningún rastro.
- Estabilidad: Los coloides son de naturaleza relativamente estable. Las partículas de la fase dispersa están en constante movimiento y quedan suspendidas en la solución.
- Naturaleza heterogénea: Los coloides son de naturaleza heterogénea porque tienen dos fases, la fase dispersa y el medio de dispersión.
- Apariencia homogénea: a pesar de que los coloides incluyen partículas suspendidas y son de naturaleza heterogénea, parecen ser una solución homogénea. Esto se debe a que las partículas suspendidas son tan pequeñas que no se pueden ver a simple vista.
Efecto Tyndall: las propiedades ópticas de las soluciones coloidales
Los coloides muestran un fenómeno conocido como el efecto Tyndall, que Tyndall identificó en 1869. Cuando proyectamos un haz de luz brillante y convergente a través de una solución coloidal oscura, la trayectoria del haz se ilumina con un resplandor azul. La dispersión de la luz por partículas coloidales se conoce como efecto Tyndall, y la ruta iluminada se conoce como cono Tyndall. Las partículas coloidales distribuidas dispersan la luz que incide sobre ellas, produciendo emisiones similares a las radiaciones ultravioleta y visible. Estas radiaciones dispersas están encendidas.
Movimiento browniano: las propiedades mecánicas de las partículas coloidales
El movimiento browniano es una característica muy significativa de las partículas dispersas en una solución coloidal. Cuando se examina una solución coloidal a través de un ultramicroscopio, las partículas coloidales pueden verse moviéndose en un patrón en zigzag. Las partículas coloidales son constantemente bombardeadas desde todas las direcciones por las moléculas en movimiento del medio de dispersión.
Por lo tanto, esto le da impulso a las partículas, lo que hace que viajen hacia adelante y choquen con otra partícula. Las colisiones hacen que la partícula coloidal viaje en un patrón de zigzag aleatorio.
Aplicación de Coloides
Los coloides tienen amplias aplicaciones de numerosas formas en industrias, aplicaciones médicas y domésticas como:
- En alimentos: Jarabe, Halwa y Sopa son ejemplos de sistemas coloidales en la cocina.
- Medicamentos: La plata coloidal, también conocida como Argyrols, funciona como antiséptico para las infecciones oculares.
- En la purificación del aire del precipitador Cottrell: esta técnica incluye la coagulación de las partículas de la solución. Cuando el polvo o el humo fluyen por la entrada de una cámara electrificada con una placa eléctrica central que se carga con la carga opuesta a una abolladura o una partícula de humo, las partículas se coagulan y el aire limpio pasa por otra salida.
- Repintado del cuero: Las pieles de animales son muy suaves; cuando se sumerge en una solución de tanino con carga opuesta a la piel del animal, las partículas se aglomeran y la piel se endurece; esto se conoce como curtido de cuero.
Problemas de muestra
Problema 1: ¿Cuáles son los cambios que pueden ocurrir en una sustancia o materia?
Solución:
Los cambios que se producen en la materia son cambios físicos y químicos. Los cambios físicos se refieren a cambios en el estado de la materia y otros factores externos, mientras que los cambios químicos se relacionan con la composición química de la materia.
Problema 2: ¿Cuál es la precaución que se debe tomar durante el proceso de diálisis?
Solución:
Durante el proceso de diálisis, el agua destilada del recipiente debe cambiarse con frecuencia para evitar la acumulación de cristaloides. De lo contrario, las impurezas volverán a difundirse.
Problema 3: ¿Cuál es la aplicación del coloide en productos industriales?
Solución:
La aplicación de coloides en productos industriales es la siguiente:
- Los coloides se utilizan como agente espesante para productos como lubricantes, lociones, pasta de dientes, etc.
- También se utiliza en la fabricación de tintas y pinturas.
- Se utiliza en medicamentos como antiséptico.
- Y, como estabilizantes en industrias alimentarias para la fabricación de productos alimenticios como mermeladas, helados, etc.
Problema 4: ¿Qué método es aplicable para la preparación de soles metálicos?
Solución:
El método de dispersión por arco de Bredig se utiliza para la preparación de soles metálicos. En este método, las partículas metálicas se rompen en partículas de sol de tamaño diminuto y se sumergen en un medio de dispersión correspondiente.
Problema 5: ¿Qué sustancia se utiliza para reducir el tamaño de poro del papel de filtro para ultrafiltración?
Solución:
Como el papel de filtro tiene un tamaño de poro grande que no es eficiente para la filtración de coloides, se utiliza una solución de colodión (solución de nitrato de celulosa) para reducir el tamaño de los poros.
Publicación traducida automáticamente
Artículo escrito por punamsingh628700 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA