La cristalización es un proceso natural que ocurre cuando los materiales se solidifican de un líquido, o cuando se precipitan de un líquido o gas. Este proceso puede llevarse a cabo provocando un cambio físico, como un cambio de temperatura, o un cambio químico como la acidez. El proceso de cristalización se lleva a cabo en función del tamaño y la forma de las moléculas involucradas y de sus propiedades químicas. Los cristales pueden estar hechos de 1 especie del átomo, diferentes especies de iones o incluso moléculas enormes como las proteínas. Algunas moléculas grandes tienen dificultades para pasar por el proceso de cristalización, ya que su química interna no es simétrica o interactúa consigo misma para evitar la cristalización.
La celda unitaria se conoce como la unidad más pequeña del cristal. Es la forma base de átomos o moléculas sobre la cual se pueden unir más unidades. Piense en esto como un bloque de construcción para niños, al que se pueden unir otros bloques. La cristalización continúa como si los bloques se unieran en todas las direcciones. Algunos de los materiales forman cristales de diferentes formas, lo que da como resultado una gran variación en forma, tamaño y color de varios cristales.
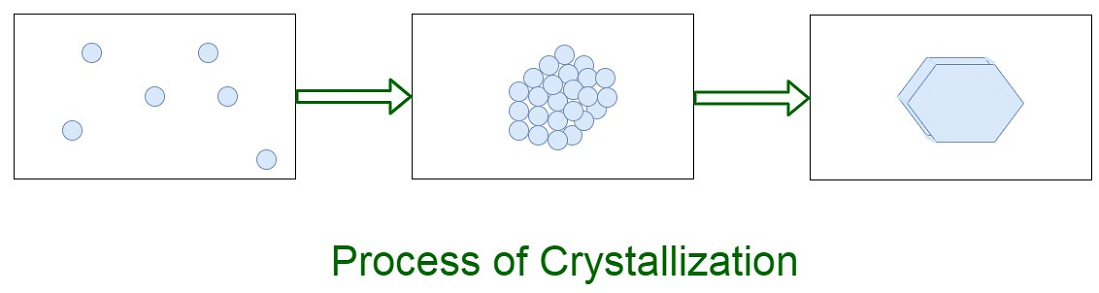
Tipos de cristalización
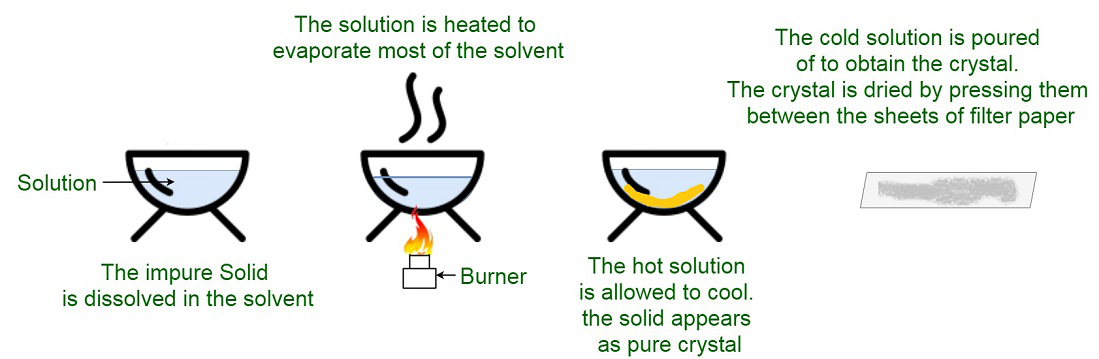
Enfriamiento Cristalización
Solución saturada a 30°C al enfriarla a 0°C la precipitación ocurre cuando se precipita una gran masa de cristales después de la hidratación del agua.
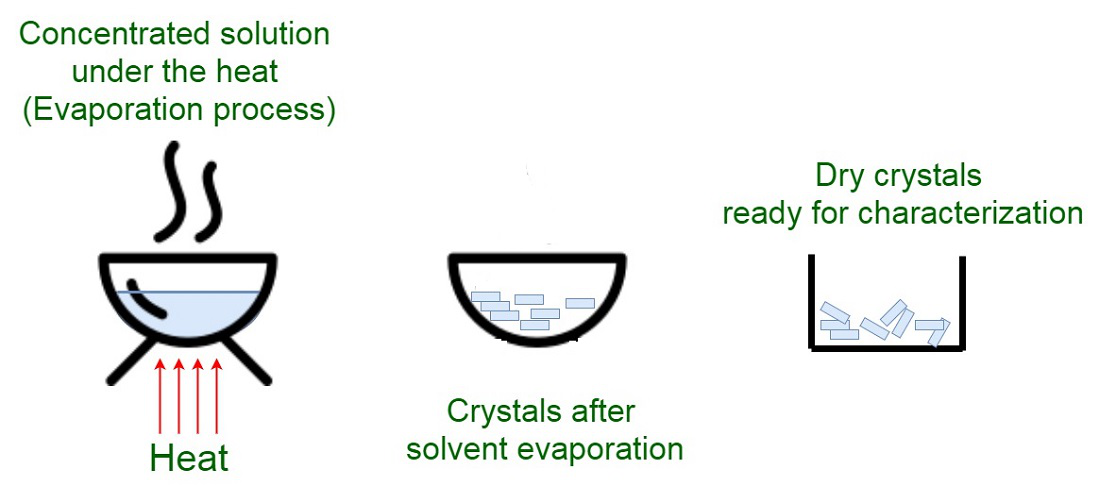
Cristalización por evaporación
A temperatura constante la precipitación de cristales al aumentar la concentración de soluto por encima del umbral de solubilidad. La relación másica soluto/disolvente se incrementa utilizando la técnica de evaporación.
Factores que afectan la cristalización
- Presencia de otra sustancia: El cloruro de sodio cristalizado de soluciones acuosas produce cristales cúbicos. Si el cloruro de sodio se cristaliza a partir de una solución que contiene una pequeña cantidad de urea, los cristales obtenidos tendrán caras octaédricas.
- Disolvente: Se prefiere el disolvente con solubilidad moderada para la cristalización. La presencia de benceno puede ayudar al crecimiento de cristales. Evite los solventes altamente volátiles.
- Nucleación: los cristales se forman inicialmente a través de » eventos de nucleación «. Después de que un cristalito se ha nucleado, debe crecer. Los sitios de nucleación son necesarios para la formación de cristales. El exceso de sitios de nucleación provoca tamaños de cristal promedio más pequeños.
- Crecimiento de cristales: Los cristales crecen por la deposición ordenada de las moléculas de soluto sobre la superficie de un cristal preexistente. El crecimiento de los cristales se ve facilitado por el entorno que cambia lentamente con el tiempo. Mantenga el recipiente de crecimiento de cristales alejado de fuentes de agitación mecánica (p. ej., vibraciones). Instale lejos de bombas de vacío, campanas, puertas, cajones, etc.
- Tasa de enfriamiento/tiempo: los cristales de calidad crecen mejor con el tiempo en condiciones cercanas al equilibrio. Cuanto más largo sea el tiempo, mejores serán los cristales. Una cristalización más rápida no es tan buena como una cristalización lenta. Cristalización más rápida, mayor probabilidad de cristales de menor calidad.
Importancia de la cristalización:
- Purificación de drogas
- Mejorar la biodisponibilidad del fármaco y elegir la forma más estable
- Un polvo cristalino se maneja fácilmente, es estable, posee buenas propiedades de fluidez y tiene una apariencia atractiva.
Aplicación de Cristalización
La cristalización es un componente clave de casi todos los procesos en la fabricación de productos farmacéuticos de molécula pequeña. Es esencial tanto en el procesamiento como en el desarrollo farmacéutico. Dado que las propiedades de un material sólido (polimorfismo) pueden afectar drásticamente el proceso o la conformidad y el efecto del producto (tasa de disolución, por ejemplo), es de suma importancia monitorear y controlar el aislamiento de sólidos para las diversas aplicaciones a través de la cristalización.
Entonces la cristalización se usa en:
- Purificación de la droga
- Mejores características de procesamiento
- Facilidad de manejo
- Estabilidad física mejorada
- Liberación sostenida
- Biodisponibilidad mejorada
- Preparación de API orgánico e inorgánico 8- separación de API de extractos galénicos
- Fabricación de API puro por alto rendimiento
Teoría de la cristalización:
Las tres etapas principales en el proceso de cristalización son:
- Súper saturación de la solución: Se puede realizar de tres formas: Calentando la solución, Enfriando la solución, Salando.
- Nucleación: se lleva a cabo en varios pasos. Durante su movimiento aleatorio, los átomos/moléculas/iones se acercarán unos a otros y formarán agregados llamados Clusters. Estos grupos se combinarán para formar un EMBRIÓN. En esta etapa, solo comienza la formación de la red. Este embrión se combina para formar NÚCLEO. A partir de núcleos se forman cristales.
- Crecimiento de cristales: una vez que se forman los cristales, se detiene la formación de núcleos y comienza el crecimiento de cristales.
Proceso de cristalización
El proceso de cristalización consta de dos eventos principales. Uno es la nucleación y el otro es el crecimiento de cristales, ambos impulsados por propiedades termodinámicas y propiedades químicas. La nucleación es el paso principal en el que las moléculas de soluto o los átomos dispersos dentro del solvente comienzan a acumularse en grupos, que se vuelven estables en las condiciones operativas actuales. Estos cúmulos estables constituyen los núcleos. Por tanto, los cúmulos llegaron a alcanzar un tamaño crítico para convertirse en núcleos estables. Es en la etapa de nucleación que los átomos o moléculas se disponen de una manera definida y periódica que define la estructura cristalina.
El crecimiento de cristales se refiere al aumento en el tamaño de los núcleos que es capaz de alcanzar el tamaño crítico del racimo. Muchos compuestos tienen el poder de cristalizar y algunos tienen diferentes estructuras cristalinas, un fenómeno llamado polimorfismo. Ciertos polimorfos pueden ser metaestables, lo que significa que, aunque no están en equilibrio termodinámico, son cinéticamente estables y requieren un aporte de energía para iniciar un cambio a la fase de equilibrio.
Ejemplos de cristalización:
A continuación se enumeran algunos ejemplos comunes de cristalización:
- La cristalización del agua para formar cubitos de hielo y nieve.
- La cristalización de la miel cuando se coloca en un frasco y se expone a las condiciones adecuadas.
- La formación de estalagmitas y estalactitas (especialmente en cuevas).
- La deposición de cristales de piedras preciosas.
¿Cuáles son las ventajas de la cristalización?
Las principales ventajas de la cristalización se enumeran a continuación.
- Se puede obtener un producto de alta pureza en un solo paso mediante el proceso de cristalización.
- Los productos secos formados a partir de la cristalización se pueden envasar y almacenar directamente.
- Los requisitos de energía y las temperaturas de funcionamiento de este proceso son relativamente bajos.
Ejemplos de preguntas
Pregunta 1. ¿Qué es la eflorescencia?
Responder:
Eflorescencia: Sales cristalinas hidratadas que al exponerse a la atmósfera pierden su humedad (agua de cristalización) parcial o totalmente a la atmósfera y pasan al estado amorfo. Ejemplos: soda de lavado (Na 2 CO 3 .10H 2 O), sal de Glauber (Na 2 SO 4 .10H 2 O).
Pregunta 2. Defina agua de cristalización, dé dos ejemplos con sus fórmulas químicas.
Responder:
La cantidad definida de agua asociada con cristales hidratados que es una parte integral del cristal se conoce como agua de cristalización.
Ejemplo:
- Vitriolo azul CuSO 4 .5H 2 O
- Sal glaubler Na 2 SO 4 .10H 2 O
Pregunta 3. ¿Los cristales anhidros de cloruro de sodio contienen agua? ¿En qué se diferencian los cristales que contienen agua de cristalización de los cristales anhidros de cloruro de sodio?
Responder:
Sustancia anhidra no contiene molécula de agua. Éstos se obtienen a partir de sales hidratadas extrayéndoles cuidadosamente el agua de cristalización.
El NaCl es una sal anhidra, pero si está presente alguna impureza como las sales del grupo II, absorben la humedad del aire porque son sustancias higroscópicas, por eso el NaCl se ve húmedo. Pero es una sal anhidra.
Pongamos un ejemplo para que aclares tu concepto al respecto,
CuSO4.5H2O + calor → CuSO4 + 5H2O
Azul blanco
(Sal con agua de cristalización) (sal anhidra)
Pregunta 4. Nombre una sal cristalina decahidratada. Dé su fórmula molecular.
Responder:
La sosa para lavar (Na 2 CO 3 .10H 2 O) es una sal cristalina decahidratada.
Pregunta 5. ¿Diferencia entre cristalización y evaporación?
Responder:
|
Cristalización |
Evaporación |
| La cristalización es el proceso de formación de cristales sólidos que precipitan de una solución, se funden o, más raramente, se depositan directamente de un gas. | La evaporación es un tipo de vaporización de un líquido que ocurre solo en la superficie de un líquido. |
| Se utiliza cuando el sólido soluble no se descompone con un fuerte calentamiento. | Se utiliza cuando el sólido soluble contiene agua de cristalización. |
| Inconveniente: cualquier impureza soluble también puede estar presente después de la evaporación. | Ventaja: el sólido puro se recoge en forma de cristales. |
| Ejemplo: agua de mar evaporándose y formando nubes. | Ejemplo: Hielo Seco. |
Pregunta 6. ¿Cuál es la diferencia entre Cristalización y Recristalización?
Responder:
La recristalización se realiza en cristales formados a partir de un método de cristalización.
La cristalización es una técnica de separación. La recristalización se usa para purificar el compuesto recibido de la cristalización.
Pregunta 7. ¿Se eliminan las impurezas insolubles de la solución durante la cristalización?
Responder:
La filtración es el proceso de separar pequeñas partículas de materia sólida de un líquido, haciendo que el líquido pase a través de los poros de alguna sustancia, llamada filtro.
Las impurezas insolubles de la solución durante la cristalización se eliminan por filtración a medida que las partículas sólidas insolubles pasan a través del filtro.
Publicación traducida automáticamente
Artículo escrito por yashkumar0457 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA