Un estado de la materia es una de las diferentes formas. En la vida cotidiana, son visibles cuatro estados de la materia: sólido, líquido, gas y plasma. Se sabe que existen muchos estados intermedios, como el cristal líquido, y ciertos estados, como los condensados de Bose-Einstein, la materia degenerada de neutrones y el plasma de quarks-gluones, solo existen en condiciones severas, como el frío extremo, densidad extrema y energía extrema. Consulte la lista de estados de la materia para obtener una lista completa de todos los estados exóticos de la materia.
Comportamiento de los gases reales
Todos los gases son instancias de la vida real. Aunque no existe tal cosa como un gas ideal, se sabe que los gases genuinos se comportan de manera ideal bajo ciertas circunstancias. El nitrógeno, el oxígeno, el hidrógeno, el dirust de carbono, el helio y otros gases reales son ejemplos.
Gas ideal y gas real: Un gas ideal obedece a la ecuación de gas ideal PV=nRT a todas las presiones y temperaturas. Sin gas, por otro lado, es excelente. Casi todos los gases varían de alguna manera del comportamiento ideal. Los gases no ideales o reales, como H 2 , N 2 y CO 2 , no obedecen la ecuación de gas ideal.
Factor de compresibilidad
Se puede utilizar una nueva función denominada factor de compresibilidad, denotada por Z, para cuantificar el grado en que el gas real se desvía del comportamiento ideal. se describe como
Z = PV/TR
La representación gráfica del factor de compresibilidad, Z, frente a P, revela el grado de desviación del comportamiento óptimo. La temperatura y la presión no tienen efecto en un gas ideal, que tiene un valor Z de 1. El valor de Z es mayor o menor que 1 determina la diferencia entre el comportamiento del gas ideal y el real. El grado de no idealidad del gas está representado por la diferencia entre la unidad y Z. La presión y la temperatura provocan desviaciones del comportamiento óptimo en un gas real. Uso de la presión y la temperatura para examinar las curvas de compresibilidad de algunos de los gases que se analizan a continuación.
Efecto de la variación de presión sobre las desviaciones
En el siguiente gráfico, el factor de compresibilidad, Z, para H 2 , N 2 y CO 2 a temperatura constante se representa frente a la presión.

Para todos estos gases, Z es prácticamente igual a uno a muy baja presión. Los gases reales se comportan casi perfectamente a bajas presiones (hasta 10 atm). A medida que aumenta la presión, H 2 exhibe un aumento constante en Z (de Z=1). Como resultado, la curva de H 2 es más alta que la curva de gas ideal en todas las presiones. Para N 2 y CO 2 , Z disminuye al principio (Z1), luego alcanza un mínimo y finalmente aumenta al aumentar la presión (Z>1). Debido a que el CO 2 es el gas que se licua más fácilmente, tiene la mayor caída en la curva.
Efecto de la temperatura en las desviaciones
El siguiente gráfico muestra gráficos de Z o PV/RT contra P para N 2 a varias temperaturas.
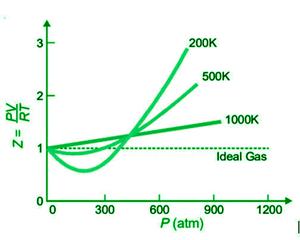
A medida que aumenta la temperatura, las desviaciones del comportamiento del gas ideal se vuelven cada vez más pequeñas, como se muestra en la forma de los gráficos. A temperaturas más bajas, la curva desciende significativamente y la pendiente de la curva es negativa. En esta situación, Z<1. A medida que aumenta la temperatura, la caída en la curva disminuye. El mínimo de la curva desaparece a cierta temperatura y permanece horizontal para una amplia gama de presiones. A esta temperatura, PV/RT es casi igual, por lo que se cumple la ley de Boyle. Como resultado, la temperatura de Boyle se refiere a la temperatura del gas. Cada gas tiene su propia temperatura de Boyle, como 332K para N 2 .
Nota :
- Los gases reales se comportan de manera aproximadamente ideal a presiones bajas y temperaturas relativamente altas, y se cumple la ecuación del gas ideal.
- Un gas real se desvía mucho de la idealidad a bajas temperaturas y presiones suficientemente altas, y la ecuación del gas ideal ya no es válida.
- A medida que el gas se acerca al punto de licuefacción, crece la desviación del comportamiento ideal.
Ecuación de Van der Waals (Causas del comportamiento real de los gases)
Según Van der Waals (1873), las desviaciones de los gases reales respecto del comportamiento ideal son atribuibles a dos postulados defectuosos de la teoría cinética. Los siguientes son algunos de ellos:
- Las moléculas de un gas no tienen volumen y tienen masas puntuales.
- No hay atracciones intermoleculares en un gas.
Como resultado, la ecuación del gas ideal PV=nRT desarrollada a partir de la teoría cinética no se pudo aplicar a los gases reales. Van der Waals señaló que las partes de presión (P) y volumen (V) de la ecuación del gas ideal debían modificarse para que fuera aplicable a los gases reales.
Corrección de volumen
El volumen de un gas es la cantidad de espacio libre en el recipiente donde las moléculas pueden moverse. El volumen V de un gas ideal es igual al volumen del recipiente. Debido a que las moléculas de gas ideal no tienen volumen, pueden moverse libremente dentro del recipiente. En contraste, Van der Waals pensó en las moléculas de un gas genuino como objetos esféricos rígidos con un volumen fijo.

Como resultado, el volumen de un gas real es el volumen ideal menos el volumen de la molécula de gas. Si b es el volumen efectivo de moléculas por mol de gas, el volumen de la ecuación del gas ideal se rectifica de la siguiente manera:
Se convierte en (V–b) para n moles de gas.
(V–nb)
Dónde,
El volumen excluido, abreviado como b, es una cantidad constante y única para cada gas.
Corrección de presión
Una molécula en el interior del gas es atraída por moléculas en todos los lados. Estas atractivas características se anulan entre sí. Una molécula a punto de impactar contra la pared del vaso, por otro lado, es atraída solo por las moléculas de un lado. Se siente obligado a entrar como resultado. Como resultado, golpea la pared con menos fuerza y la presión real del gas, P, es menor que la presión ideal. Si la presión real P es menor que la presión ideal P ideal por un factor p, tenemos
P = P ideal – p
P ideal = P + p

Van der Waals determinó el valor de la cantidad p de la siguiente manera:
p = un 2 /V 2
Donde n es el número total de moléculas de gas en el volumen V y a denota la constante de proporcionalidad del gas. Como resultado, la presión P de la ecuación del gas ideal se revisa a:
Para n moles de gas, utilice (P+an 2/ V 2 ).
Cuando los números ajustados de presión y volumen se sustituyen en la ecuación del gas ideal, PV=nRT, obtenemos:
(p+an 2/ V 2 ) (V–nb) = nRT
Para n moles de un gas, esto se conoce como ecuación de Van der Waals o ecuación de gas real. La ecuación de Van der Waals se convierte en: para 1 mol de gas (n=1):
(p+a/V 2 )(V–b) = RT
Ejemplos de preguntas
Pregunta 1: Defina gas ideal y gas real.
Responder:
Un gas ideal obedece a la ecuación de gas ideal PV = nRT a todas las presiones y temperaturas. Sin gas, por otro lado, es excelente. Casi todos los gases varían de alguna manera del comportamiento ideal. Los gases no ideales o reales, como H 2 , N 2 y CO 2 , no obedecen la ecuación de gas ideal.
Pregunta 2: ¿Qué es el factor de compresibilidad?
Responder:
El grado en que el gas real se desvía del comportamiento ideal se puede expresar mediante una nueva función denominada factor de compresibilidad, indicada por Z.
Z=VP/RT
Pregunta 3: ¿Cuál es el comportamiento ideal de los gases?
Responder:
Un gas ideal obedece a la ecuación de gas ideal PV=nRT a todas las presiones y temperaturas. Sin embargo, ningún gas es ideal. Casi todos los gases varían de alguna manera del comportamiento ideal.
Pregunta 4: ¿Cuál es el comportamiento de los gases reales?
Responder:
Los gases que se apartan del comportamiento ideal se conocen como gases reales. El grado en que el gas real se desvía del comportamiento ideal se puede expresar mediante una nueva función denominada factor de compresibilidad, indicada por Z.
Z=VP/RT
Una gráfica del factor de compresibilidad, Z, vs P puede revelar el grado de divergencia del comportamiento ideal. Z=1 para un gas ideal, y no se ve afectado por la temperatura o la presión.
Pregunta 5: ¿Cuáles son las causas del comportamiento real de los gases? Derive la ecuación de Van der Waals.
Responder:
Según Van der Waals (1873), las desviaciones de los gases reales respecto del comportamiento ideal son atribuibles a dos postulados defectuosos de la teoría cinética. Los siguientes son algunos de ellos:
1. En un gas, las moléculas no tienen volumen y tienen masas puntuales.
2. No hay atracciones intermoleculares en un gas.
Como resultado, la ecuación del gas ideal PV=nRT desarrollada a partir de la teoría cinética no se pudo aplicar a los gases reales. Van der Waals señaló que tanto los elementos de presión (P) como de volumen (V) de la ecuación del gas ideal debían modificarse para que fuera aplicable a los gases reales.
Van der Waals cambió la ecuación de los gases ideales para hacerla aplicable a todos los gases. La ecuación de Van der Waals para n moles de gases,
(p+an 2 /V 2 )(V–nb)=nRT
Pregunta 6: Obtenga la fórmula para la corrección de volumen.
Responder:
El volumen de un gas real es igual al volumen ideal menos el volumen ocupado por las moléculas del gas. Si b es el volumen efectivo de moléculas por mol de gas, el volumen en la ecuación del gas ideal se rectifica de la siguiente manera:
(Vb)
Para n moles de gas,
(V–nb)
Donde el volumen excluido, que es constante y único para cada gas, se denota con la letra b.
Publicación traducida automáticamente
Artículo escrito por omkarsinghbaghel y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA