La velocidad de la luz está determinada por la naturaleza del medio a través del cual viaja. Como resultado, a medida que el haz de luz pasa de un medio a otro, se desvía o refracta de su curso inicial. Cuando se transmite un rayo de luz blanca a través de un prisma, se ve que la onda con la longitud de onda más corta se desvía más que la onda con la longitud de onda más larga.
Debido a que la luz blanca típica se compone de ondas con todas las longitudes de onda visibles, un rayo de luz blanca se divide en una secuencia de bandas de colores conocidas como espectro. La luz roja, que tiene la longitud de onda más larga, es la que menos se desvía, mientras que la luz violeta, que tiene la longitud de onda más corta, es la que más se desvía. El espectro visible de la luz blanca va desde el violeta a 7,50 × 10 14 Hz hasta el rojo a 4 × 10 14 Hz. Esto se conoce como un espectro continuo. Porque el violeta se funde con el azul, el azul con el verde, y así sucesivamente. Cuando se forma un arco iris en el cielo, produce un espectro similar.
Tenga en cuenta que la luz visible es solo una parte menor de la radiación electromagnética. Cuando la radiación electromagnética interactúa con la materia, los átomos y las moléculas pueden absorber energía y pasar a un estado de mayor energía. Estos están en un estado inestable debido al aumento de energía. Los átomos y las moléculas liberan radiaciones en varias partes del espectro electromagnético para volver a su estado de energía normal (estados de energía más bajos y más estables).
Evidencia de niveles de energía electrónicos cuantificados
Contribución de Planck
En algunos sistemas, la energía está cuantizada, lo que significa que el sistema solo puede tener energías particulares y no un continuo de energías, como en la situación clásica. Esto sería análogo a que un automóvil solo pueda moverse a velocidades específicas porque su energía cinética solo puede tener ciertos valores. También descubrimos que algunos tipos de transferencia de energía ocurren con porciones discretas de energía. Si bien la mayoría de nosotros somos conscientes de que la materia puede cuantificarse en grupos llamados átomos, moléculas y similares, somos menos conscientes de que la energía también puede cuantificarse. La cuantización de la energía proporcionó algunos de los primeros indicios de la superioridad de la mecánica cuántica sobre la física convencional.
Planck pudo caracterizar adecuadamente la geometría científicamente conocida del espectro del cuerpo negro a través de la cuantificación del oscilador. Esta fue la primera demostración de que la energía se puede cuantificar a pequeña escala y le valió el Premio Nobel de Física en 1918. A pesar de que la teoría de Planck se basa en observaciones de un objeto macroscópico, su análisis se basa en átomos y moléculas. . El propio Planck dudaba en aceptar su propia teoría de que los niveles de energía no son continuos porque era una desviación radical de la física tradicional. La explicación de Einstein del efecto fotoeléctrico, que avanzó en la cuantización de la energía, aumentó sustancialmente la aceptación general de la cuantización de la energía de Planck.
Espectros de emisión y absorción
Cuando las radiaciones electromagnéticas interactúan con los átomos y las moléculas de la materia, los electrones de estos átomos pueden absorber energía y saltar a un estado de mayor energía, lo que hace que pierdan estabilidad. Deben regresar del nivel de energía más alto al estado de energía más bajo anterior para restablecer su estabilidad. Para ello, estos átomos y moléculas liberan radiaciones en diversas partes del espectro electromagnético .
- El espectro de emisión es el rango de radiación liberada por electrones en átomos o moléculas excitados. Un espectro de emisión se define como el espectro de radiación liberado por una sustancia que ha absorbido energía. Los átomos, moléculas o iones excitados son aquellos que han absorbido radiación. Para generar un espectro de emisión, se aplica energía a una muestra calentándola o irradiándola, y se mide la longitud de onda (o frecuencia) de la radiación liberada a medida que la muestra libera la energía absorbida.
- Un espectro de absorción es análogo al negativo fotográfico de un espectro de emisión. Se pasa un continuo de radiación a través de una muestra que absorbe varias longitudes de onda de radiación. Los intervalos negros en el deslumbrante espectro continuo son causados por la longitud de onda faltante, que corresponde a la radiación absorbida por la materia.
- La espectroscopia se refiere al estudio de los espectros de emisión o absorción. Como se indicó anteriormente, el espectro de luz visible era continuo, ya que todas las longitudes de onda (de rojo a violeta) de luz visible estaban representadas en los espectros. Los espectros de emisión de los átomos en fase gaseosa, por otro lado, no muestran un rango continuo de longitudes de onda del rojo al violeta, sino que emiten luz en longitudes de onda específicas con espacios oscuros entre ellas.
- Debido a que la aparición de líneas brillantes en los espectros identifica la radiación emitida, dichos espectros se conocen como espectros de líneas o espectros atómicos . En el estudio de la estructura electrónica, los espectros de emisión lineal son de gran importancia. Cada elemento tiene un espectro de emisión de línea distinto .
- De la misma manera que las huellas dactilares se utilizan para identificar a las personas, las líneas características de los espectros atómicos se pueden utilizar en el análisis químico para identificar átomos desconocidos. La combinación perfecta de líneas en un espectro de emisión de átomos de un elemento conocido con líneas en una muestra desconocida demuestra rápidamente la identidad de este último.
- Robert Bunsen (1811-1899), químico alemán, fue uno de los primeros en utilizar espectros de líneas para identificar elementos. Elementos como el rubidio (Rb), el cesio (Cs), el talio (Tl), el indio (In), el galio (Ga) y el escandio (Sc) se identificaron mediante el análisis espectroscópico de sus cristales. Se utilizó el enfoque espectroscópico para encontrar el elemento helio (He) en el sol.
Línea Espectro de Hidrógeno
Todos sabemos que los electrones en un átomo o molécula absorben energía y se excitan, saltan de un nivel de energía más bajo a uno más alto y emiten radiación cuando regresan a sus estados originales. Este fenómeno también explica el espectro de emisión a través del hidrógeno, a veces conocido como espectro de emisión de hidrógeno.
A fines del siglo XIX, se descubrió que cuando un gas se excita con una descarga eléctrica y la luz liberada se examina a través de una rejilla de difracción, el espectro observado consiste en líneas discretas con longitudes de onda bien definidas en lugar de una banda continua de luz. Los experimentos revelaron que las longitudes de onda de las líneas coincidían con el elemento químico que emitía la luz. Eran una huella dactilar atómica creada por la estructura intrínseca del átomo.
El espectro de hidrógeno es una prueba crucial para demostrar la estructura electrónica cuantificada de un átomo. Cuando se transmite una descarga eléctrica a través de una molécula de hidrógeno gaseoso, los átomos de hidrógeno se disocian. Hace que se emita radiación electromagnética, que es iniciada por átomos de hidrógeno energéticamente excitados. El espectro de emisión de hidrógeno se compone de radiación de frecuencia discreta. Las series de radiación llevan el nombre de los científicos que las descubrieron.
Cuando se realiza una descarga eléctrica sobre hidrógeno gaseoso, las moléculas de H 2 se disocian y los átomos de hidrógeno energéticamente excitados que se crean emiten radiación electromagnética de frecuencia discreta. El espectro del hidrógeno está formado por múltiples series de líneas que han recibido el nombre de sus descubridores. Sobre la base de hallazgos reales, Balmer demostró en 1885 que si las líneas espectrales se representan en términos de número de onda, las líneas visibles del espectro del hidrógeno satisfacen la siguiente fórmula: donde n es un número entero igual o mayor que 3 (es decir, n = 3,4,5,… La serie de Balmer se refiere a la serie de líneas descritas por esta fórmula.Las únicas líneas en el espectro del hidrógeno que ocurren en el área visible del espectro electromagnético son las series de Balmer.
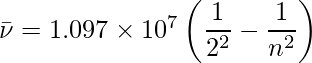
1.097 × 10 7 se conoce como la constante de Rydberg del hidrógeno . Las primeras cinco series de líneas que corresponden a n 1 = 1, 2, 3, 4, 5 se conocen como series de Lyman, Balmer, Paschen, Bracket y Pfund, respectivamente.
El átomo de hidrógeno tiene el espectro de líneas más simple de cualquier elemento. Para átomos más pesados, el espectro de líneas se vuelve cada vez más complicado. Sin embargo, hay algunas características que comparten todos los espectros de líneas, como el hecho de que el espectro de líneas de cada elemento es único y que existe una regularidad en el espectro de líneas de cada elemento.
Espectro de emisión y espectro de absorción
- Un espectro de absorción es análogo a un negativo de un espectro de emisión.
- Se bombardean radiaciones electromagnéticas sobre una muestra que absorbe ciertas longitudes de onda de radiación para observar el espectro de absorción.
- La longitud de onda de la radiación absorbida por la materia contribuye a la longitud de onda que falta, dejando vacíos oscuros en el deslumbrante espectro continuo.
- Cada elemento tiene un espectro de emisión de línea distinta. La espectroscopia es el estudio del espectro de emisión o espectro de absorción.
Ejemplos de preguntas
Pregunta 1: ¿Qué son las partículas subatómicas?
Responder:
Las partículas subatómicas son las partículas que forman un átomo. Esta palabra a menudo se refiere a protones, electrones y neutrones.
Pregunta 2: ¿Cómo varían las estructuras atómicas de los isótopos?
Responder:
Difieren en términos de la cantidad total de neutrones contenidos en el núcleo del átomo, según lo descrito por sus números de nucleones.
Pregunta 3: ¿Cuáles son las deficiencias del modelo atómico de Bohr?
Responder:
La estructura de un átomo, según este modelo atómico, proporciona predicciones de espectro deficientes para átomos más grandes. Tampoco tiene en cuenta el efecto Zeeman. Solo podía explicar con éxito el espectro del hidrógeno.
Pregunta 4: ¿Cómo se puede determinar el número total de neutrones en el núcleo de un isótopo?
Responder:
El número de masa de un isótopo se calcula utilizando el número total de protones y neutrones en el isótopo. El número atómico describe el número total de protones en el núcleo. Como resultado, el número de neutrones se calcula restando el número atómico del número másico.
Publicación traducida automáticamente
Artículo escrito por Prateek Sharma 7 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA