En la clasificación de ácido, base y sal, los nitratos de amonio entran en la categoría de sal inorgánica. Que se forma por la reacción de un ácido como HNO 3 y una base como NH 4 OH. Está hecho de átomos de nitrógeno, oxígeno e hidrógeno. El nitrato de amonio se usa comúnmente en fertilizantes, pirotecnia, herbicidas e insecticidas; y en la fabricación de rust nitroso. El estudio de los nitratos de amonio pertenece a la química inorgánica y juega un papel vital en la fabricación de muchos otros compuestos inorgánicos.
Según la tabla periódica actual, a continuación se muestran algunas comparaciones entre nitrógeno, oxígeno e hidrógeno:
| Propiedades/Elemento | Nitrógeno | Oxígeno | Hidrógeno |
| Símbolo químico | norte | O | H |
| Número atómico | 7 | 8 | 1 |
| Masa atomica | 14 | dieciséis | 2 |
| Estados físicos | gas | gas | gas |
| electrón de valencia | 5 | 6 | 1 |
| Valencia | 3 | 2 | 1 |
| Punto de fusion | 63.14K | 54.36K | 13,99 K |
| Punto de ebullición | 77.36K | 90.19K | 20.28K |
| Metal / no metal | no metal | no metal | no metal |
| Porcentaje de presencia en la atmósfera | 78 | 21 | 0.00005 |
El nitrato de amonio es una sal cristalina incolora, que consta de dos iones; un catión, el ion amonio (NH 4 + ) y un anión el ion Nitrato (NO 3 – ). El catión y el anión se mantienen unidos por un enlace electrovalente robusto. Es altamente soluble en agua.
- La fórmula química del nitrato de amonio es NH 4 NO 3 . Se compone de 2 átomos de nitrógeno, 3 átomos de oxígeno y 4 átomos de hidrógeno.
- La fórmula molecular del nitrato de amonio es N 2 H 4 O 3 .
- La masa molar es 80.052 g/mol
Estructura
La estructura del nitrato de amonio se compone de dos iones (amonio y nitrato), que se pueden mostrar a continuación:
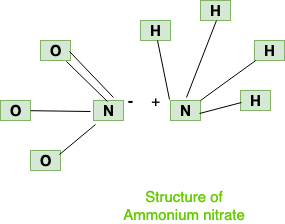
Propiedades químicas
- Después de la explosión, este compuesto da nitrógeno (N 2 ), oxígeno (O 2 ) y agua.
- Al calentarse, este compuesto se descompone para formar rust nitroso (N 2 O) y agua.
- A pesar de ser un componente de muchos explosivos, el nitrato no es un explosivo por sí mismo. Debe mezclarse con un explosivo primario como una azida para hacer un explosivo.
- Cuando el NH4NO3 reacciona con los hidrrusts de metales alcalinos, se obtienen nitratos de metales alcalinos y amoníaco como productos.
Propiedades físicas
- Este compuesto tiene sensibilidades de choque y fricción muy bajas.
- La disolución de NH 4 NO 3 en H 2 O es de naturaleza endotérmica.
- Tiene una estructura cristalina trigonal.
- El nitrato de amonio es un sólido cristalino de color blanco o gris.
- Es soluble en agua: teniendo una solubilidad de 150g/100ml a 20°C. La solubilidad aumenta a 1024g/100ml cuando la temperatura se eleva a 100°C.
Ocurrencia
Formación en laboratorio : NH 4 NO 3 se puede preparar en laboratorio a partir de la reacción ácido-base entre ácido nítrico y amoníaco.
La ecuación química se puede establecer de la siguiente manera:
NH 3 + HNO 3 = NH 4 NO 3
Formación natural: El nitrato de amonio se encuentra como el mineral natural gwihabaite en las regiones más secas del desierto de Atacama en Chile. Se extrajo allí hasta que el proceso Haber-Bosch hizo posible sintetizar nitratos a partir del nitrógeno atmosférico, lo que hizo que la extracción de nitratos quedara obsoleta.
El proceso Haber-Bosch es un proceso orgánico hecho por el hombre y es el principal procedimiento industrial para la fabricación de amoníaco en la actualidad. Lleva el nombre de sus inventores, los químicos alemanes Haber y Carl Bosch, quienes lo desarrollaron en la primera década del siglo XX. El proceso convierte el nitrógeno atmosférico (N2) en amoníaco (NH3) mediante una reacción con hidrógeno (H2) empleando un catalizador metálico a altas temperaturas y presiones:
N 2 + 3 H 2 -> 2 NH 3
usos
El nitrato de amonio es uno de los productos químicos populares que se utiliza en diferentes sectores como la agricultura, los nutrientes, la minería, etc. A continuación se detallan puntos más detallados sobre el uso del nitrato de amonio.
- Se usa más comúnmente en fertilizantes artificiales, en técnicas pirotécnicas, herbicidas e insecticidas.
- Utilizado en la fabricación de rust nitroso.
- Se utiliza como absorbente de rusts de nitrógeno.
- Ingrediente de mezclas congelantes.
- Un oxidante en propulsores de cohetes
- Nutriente para la levadura y antibiótico
- Ampliamente utilizado en explosivos, especialmente como mezcla de aceite para voladura de rocas y en minería.
- Los nitratos y nitritos se utilizan para curar carnes y desarrollar el sabor característico y el color rosado para evitar la ranciedad y el crecimiento de esporas de clostridium botulinum en o sobre las carnes.
Curiosidades recientes: el 4 de agosto de 2020, la capital libanesa, Beirut, experimentó una explosión masiva causada por más de 2700 toneladas de nitrato de amonio almacenadas incorrectamente.
El gobierno modificó las reglas para el nitrato de amonio para frenar su hurto, introdujo disposiciones para combatir incendios y mejoró las formas de manejar y almacenar el químico a la luz de las lecciones aprendidas de la explosión mortal que mató a unas 140 personas.
Ejemplos de preguntas
Pregunta 1: ¿Es el nitrato de amonio un buen fertilizante?
Responder:
El fertilizante de nitrato de amonio es la aplicación más común del compuesto, pero también tiene una calidad muy volátil, lo que lo hace útil en algunas industrias. el uso de NH 4 NO 3 (nitrato) en jardines y campos de cultivo a gran escala estimula el crecimiento de las plantas y proporciona una fuente de nitrógeno disponible para las plantas.
Pregunta 2: ¿Qué sucede cuando se mezcla agua y nitrato de amonio?
Responder:
Se siente frío cuando el nitrato de amonio se disuelve en agua, lo que indica que esta reacción es una reacción endotérmica. En una reacción endotérmica, el nitrato de amonio se disuelve en agua y el agua absorbe calor en lugar de liberarlo. Contiene enlaces iónicos estrechamente empaquetados.
Pregunta 3: ¿Enumere algunos usos bien conocidos del nitrato de amonio?
Responder:
El Nitrato de Amonio se utiliza como ingrediente para la fabricación de explosivos, gases anestésicos, fertilizantes, compresas frías, etc.
Pregunta 4: Indique la razón detrás de la naturaleza explosiva del nitrato de amonio.
Responder:
El nitrato de amonio no es un explosivo por naturaleza. Sin embargo, es uno de los ingredientes utilizados para la fabricación de explosivos. El nitrato de amonio se usa como oxidante y cuando se agrega con otros ingredientes como combustible, etc., se vuelve explosivo. Para que tales mezclas explosivas exploten, se requieren iniciadores como detonadores.
Pregunta 5: ¿Cuáles son los productos que se forman cuando calentamos Nitrato de Amonio?
Responder:
Al calentarlo se forman nitrato de amonio, rust nitroso y vapor de agua. La reacción química para el mismo se da a continuación:
Publicación traducida automáticamente
Artículo escrito por Shivam.Pradhan y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA
