El carbono es un elemento químico de símbolo C. Su número atómico es 6 y su configuración electrónica es 1s 2 2s 2 2p 2 . Pertenece al grupo 14 de la tabla periódica. Es uno de los elementos no metálicos fundamentales. Es la columna vertebral química de toda la vida en la tierra. El carbono es la capacidad de formar fácilmente enlaces con otros átomos. Se utiliza como combustible en forma de carbón, gas metano y petróleo crudo. Los alótropos de carbono son el grafito, el diamante y el fullereno.
El oxígeno es un elemento químico de símbolo O. Su número atómico es 8 y su configuración electrónica es 1s 2 2s 2 2p 6 . Es el elemento más abundante que se encuentra en la tierra. Es un miembro del grupo calcógeno en la tabla periódica. Desempeña un papel fundamental en la respiración. Se utiliza para quemar combustibles. El oxígeno se usa en la industria para cortar, soldar y fundir metales y también se usa en el tratamiento del agua.
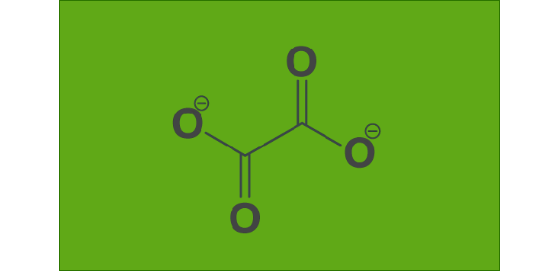
fórmula de oxalato
El oxalato es un anión con la fórmula C 2 O 4 2- . Es una molécula natural que se encuentra en abundancia en plantas y humanos. Se encuentran altos niveles de oxígeno en la espinaca, la batata, las almendras, la remolacha y las nueces. Demasiado oxalato en nuestra orina da como resultado una condición médica llamada hiperoxaluria comúnmente conocida como cálculos renales. La dieta se considera una medida preventiva además de los medicamentos para tratar los cálculos renales y la eliminación de los alimentos con alto contenido de oxalato de la dieta. Nuestro cuerpo produce ácido oxálico que puede formar cristales de oxalato y causar dolor, rigidez e inflamación en músculos y articulaciones.
Estructura del oxalato
La fórmula química del oxalato es C 2 O 4 2- . Para dibujar la estructura de Lewis para esto, podemos encontrar los electrones de valencia del carbono y el oxígeno. El carbono tiene cuatro electrones de valencia aquí tenemos 2 átomos de carbono y el oxígeno tiene seis electrones de valencia tenemos 4 átomos de oxígeno así que en total tenemos 34 electrones de valencia para el C 2 O 4 2-.En esto los carbonos están en el medio de la estructura y luego tenemos 4 carbonos colocados dos alrededor de cada uno de los átomos de carbono. Y formar los enlaces entre estos átomos para completar el octeto. Todos los átomos de oxígeno completan el octeto, pero aquí tenemos un problema al observar los carbonos, cada carbono solo tiene seis electrones de valencia, su octeto no está completo para cumplir con esto para formar el doble enlace entre los átomos de carbono y oxígeno.
Propiedades físicas del oxalato
- El peso molecular del oxalato es 88,019 g/mol
- La masa monoisotópica de oxalato es 87,98 g/mol
- El número de aceptores de hidrógeno es 4.
Propiedades químicas del oxalato
- La fórmula química del oxalato es C 2 O 4 2- .
- Las sales de oxalato de sodio y oxalato de potasio son solubles en agua
- Los oxalatos de calcio son insolubles en agua.
- El oxalato de sodio reacciona con el ácido sulfúrico para formar sulfato de sodio y ácido oxálico.
Na 2 C 2 O 4 + H 2 SO 4 —-> Na 2 SO 4 +H 2 C 2 O 4
- El oxalato de potasio reacciona con el nitrato de plata para formar oxalato de plata sólido y nitrato de potasio.
2AgNO 3 + K 2 C 2 O 4 —–> Ag 2 C 2 O 4 + 2KNO 3
Peligros para la salud del oxalato
- El oxalato puede causar la formación de cálculos renales. La mayoría de los cálculos renales están compuestos de oxalato de calcio.
- Puede causar erupciones en la piel.
- En las mujeres, algunos casos de vulvodinia pueden estar asociados al ácido oxálico
- Los alimentos que contienen altas cantidades de oxalatos no deben consumirse crudos. Deben hervirse en agua antes de su consumo.
- Puede cambiar el estado de ánimo
- Puede causar dolor al orinar
- Puede causar movimientos intestinales dolorosos.
Usos de oxalato
- El oxalato se utiliza en la eliminación de rust.
- Se utiliza en el tratamiento de la ansiedad y la depresión.
- Se utiliza en fotografía.
- Utilizado en el grabado de platino.
- Se utiliza en la eliminación de manchas de tinta.
- El oxalato de cobalto se utiliza en la producción de catalizadores de cobalto.
Ejemplos de preguntas
Pregunta 1: ¿Cómo afectan los oxalatos al organismo?
Responder:
Cuando los niveles de oxalato son altos, existe una mayor probabilidad de que se una a los cálculos renales que forman calcio. Debido a que los oxalatos se unen a minerales como el calcio, pueden evitar que su cuerpo absorba nutrientes beneficiosos en su tracto digestivo. Y algunos de los síntomas son mareos, erupciones en la piel, dolor al orinar y dolor al defecar.
Pregunta 2: ¿Es lo mismo el oxalato que el ácido oxálico?
Responder:
El ácido oxálico es un compuesto orgánico que se encuentra en muchas plantas, incluidas las verduras de hojas verdes, frutas, nueces de cacao y semillas. Los términos ácido oxálico y oxalato se usan indistintamente en la ciencia de la nutrición.
Pregunta 3: ¿Cómo nos dañan los oxalatos de calcio?
Responder:
Los cristales de oxalato de calcio son la causa más común de cálculos renales. Cuando comemos alimentos ricos en calcio, éste se une al oxalato en el estómago y los intestinos antes de pasar a los riñones. Una dieta rica en líquidos ayuda a reducir la cantidad de oxalato que absorbe nuestro cuerpo, por lo que es menos probable que se formen cálculos.
Pregunta 4: ¿Cómo podemos reducir los oxalatos?
Responder:
Podemos reducir los oxalatos llevando una buena dieta y adoptando un estilo de vida saludable. Beber mucha agua ayuda a nuestro cuerpo a eliminar los oxalatos. Evite comer demasiada proteína. Coma menos sal y tome menos frutas y verduras que contengan oxalatos.
Pregunta 5: ¿El oxalato es orgánico o inorgánico?
Responder:
El oxalato es un ácido orgánico que se deriva principalmente de tres fuentes de alimentos, hongos, posiblemente Candida , y también del metabolismo humano. Estos son compuestos orgánicos que contienen exactamente dos grupos de ácido carboxílico.
Pregunta 6 : ¿Cuáles son los usos del oxígeno?
Responder:
El oxígeno es un elemento químico de símbolo O. Desempeña un papel fundamental en el proceso de respiración. Se utiliza en la quema de combustibles. Se utiliza en la industria para cortar, soldar y fundir metales. Se utiliza en tratamiento de agua y combustión química.
Publicación traducida automáticamente
Artículo escrito por veeracharyu y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA