El electrón final de un elemento del bloque P entra en uno de los tres orbitales p de la capa en la que se encuentra. Hay seis grupos de elementos del bloque p, ya que una subcapa p tiene tres orbitales p degenerados, cada uno de los cuales puede contener dos electrones.
Debido a su tendencia a perder un electrón, los elementos del bloque P son lustrosos y típicamente fuertes conductores de electricidad y calor. En un elemento de bloque P como el galio, puede encontrar algunas características sorprendentes de los elementos. Es un metal que se derrite en tu palma. Debido a que el silicio es un componente clave del vidrio, también es uno de los metaloides más importantes en el grupo de bloques p.
fosfina
La fosfina es un hidruro de fósforo con la fórmula PH 3 . La fosfina es un gas peligroso que es inflamable. Se fabrica comúnmente en empresas y laboratorios debido a sus importantes aplicaciones industriales.
La fosfina se puede encontrar en la sangre, la orina y la saliva humanas en la naturaleza.
Estructura y fórmula de la fosfina
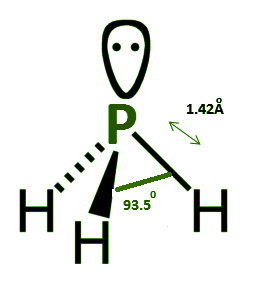
La fosfina tiene una estructura piramidal trigonal. El par solitario de electrones presentes en el fósforo hace que se altere la simetría de la molécula. La hibridación sp 3 ocurre en el fósforo. Están presentes tres pares enlazados y un par solitario de electrones. El ángulo del enlace H-P-H es de 93,5 o , mientras que la longitud del enlace P-H es de 1,42 pm.
Preparación de fosfina
- Hidrólisis de fosfuros metálicos con fosfuro de calcio: los fosfuros metálicos reaccionan con agua o HCl para producir fosfina.
Ca 3 P 2 +6H 2 O→2PH 3 +3Ca(OH) 2
Ca 3 P 2 +6HCl→2PH 3 +3CaCl 2
- A partir del ácido fosforoso, se forma fosfina pura a través de la descomposición del H 3 PO 3 .
4H 3 PO 3 →3H 3 PO 4 +PH 3
- Preparación a partir de fósforo: calentar fósforo blanco en una solución concentrada de NaOH en un ambiente inerte de CO 2 produce PH 3 .
P 4 +3NaOH+3H 2 OPH 3 +3NaH 2 PO 2
Purificación de Fosfina
La fosfina pura es una sustancia no inflamable. Debido a la presencia de vapores de P 2 H 4 o P 4 , se vuelve combustible. La fosfina se refina absorbiéndola en HI y convirtiéndola en PH 4 l. Cuando combinas esto con hidrrust de potasio, obtienes fosfina.
PH 4 I+KOH→PH 3 +KI+H 2 O
Propiedades físicas de la fosfina
- Es un gas incoloro que es extremadamente peligroso.
- Como se indicó anteriormente, el fósforo en su forma pura no es inflamable. Sin embargo, es combustible debido a la presencia de vapor de P 4 . Cuando el fósforo entra en contacto con sustancias oxidantes como HNO 3 , cloro o vapores de bromo, puede incendiarse. Puede incendiarse incluso si solo hay una pequeña cantidad o rastros de estos químicos oxidantes.
- Tiene un olor característico a pescado podrido.
- Es sólo ligeramente soluble en agua.
- Tiene un punto de ebullición de –87,7 ∘ Celsius.
Propiedades químicas de la fosfina
- La fosfina, como el amoníaco, es una base de Lewis. Cuando reacciona con HI, HBr y HCl, produce compuestos de fosfonio.
PH 3 +Hl→PH 4 l
PH 3 +HBr→ PH 4Br
PH 3 +HCl→PH 4 Cl
- Combustibilidad: cuando se quema fósforo, se produce pentrust de fósforo y agua.
2PH 3 +4O 2 →P 2 O 5 +3H 2 O
- Reacción con cloro
PH 3 +4Cl 2 →PCl 5 +3HCl
- En circunstancias normales, no se encenderá. Explota con llamas cuando se calienta, liberando ácido fosfórico.
- Cuando se expone a sustancias oxidantes como HNO 3 , Cl 2 y Br 2 , explota dramáticamente.
- El PH 3 del agua se descompone en presencia de luz para producir P rojo y H 2 O.
PH 3(H2O) →P(rojo)+H 2 O
- El fosfuro de cobre y el fosfuro de mercurio se generan cuando la fosfina se absorbe en sulfato de cobre o cloruro de mercurio.
3CuSO 4 +2PH 3 →Cu 3 P 2 +3H 2 SO 4
3HgCl 2 +2PH 3 →Hg 3 P 2 +6HCl
Usos de la fosfina
- La fosfina es una sustancia química que se utiliza para fabricar fosfuros metálicos.
- La señal de Holme y las cortinas de humo contienen fósforo.
Señal de Holme:
El hecho de que la fosfina se queme espontáneamente la convierte en una candidata probable para su uso en la señal de Holme. Cuando los barcos requieren asistencia, los contenedores llenos de carburo de calcio y fosfuro de calcio se perforan y se arrojan al agua. Los gases de acetileno y fosfina se producen como resultado de la interacción con el agua. Estos gases emiten una señal cuando se queman en el aire.
cortina de humo:
Cuando el fosfuro de calcio se sumerge en agua, crea una cantidad considerable de fosfina, lo que da como resultado una cortina de humo. Durante el conflicto, esto se empleó para ocultar las tropas del enemigo.
En las formulaciones para el control de roedores e insectos, se utilizan fumigantes de fosfina.
Ejemplos de preguntas
Pregunta 1: ¿Cuáles son las propiedades de la fosfina?
Responder
- La fosfina es un gas incoloro y muy tóxico.
- Tiene un olor característico a pescado podrido.
- Tiene una baja solubilidad en agua.
Pregunta 2: ¿Cuáles son los usos de la fosfina?
Responder
La fosfina se emplea en la cortina de humo, la señal de Holme y los insecticidas y rodenticidas como fumigante.
Pregunta 3: ¿Cuál es la estructura de la fosfina?
Responder
Con un par solitario de electrones en P, la estructura es bipiramidal trigonal. Están presentes tres pares enlazados y un par solitario de electrones. El ángulo de la conexión es de 93,5 grados. La longitud del enlace P-H es 1,42 Armstrong.
Pregunta 4: ¿Cómo se prepara el gas fosfina en el laboratorio?
Responder
El fósforo blanco se quema con una solución fuerte de NaOH en un ambiente inerte de CO 2 para producir fosfina en el laboratorio.
P 4 +3NaOH+3H 2 O→PH 3 +3NaH 2 PO 2
Pregunta 5: ¿Cómo purificar la fosfina?
Responder
La fosfina se refina mediante la absorción de impurezas en HI, produciendo PH 4 l, que luego se trata con hidrrust de potasio para obtener fosfina.
PH 4 l+KOH→KI+H 2 O+PH 3
Pregunta 6: ¿Qué es la fosfina?
Responder
La fosfina tiene la fórmula PH3 y es un hidruro de fósforo. La fosfina es un gas volátil y peligroso. Debido a sus aplicaciones industriales vitales, se fabrica de forma rutinaria en empresas y laboratorios.
En la naturaleza, la fosfina se puede encontrar en la sangre, la orina y la saliva humanas.
Publicación traducida automáticamente
Artículo escrito por amanarora3dec y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA