Los metales de transición se combinan para formar una gran cantidad de compuestos complejos en los que los átomos metálicos se unen a una serie de aniones o moléculas neutras mediante el intercambio de electrones. En el lenguaje moderno, estos compuestos se denominan compuestos de coordinación. La química de los compuestos de coordinación es muy importante en la química inorgánica moderna. La clorofila, la hemoglobina y la vitamina B12 son compuestos de coordinación de magnesio, hierro y cobalto, respectivamente. Los compuestos de coordinación se utilizan en una variedad de procesos metalúrgicos, catalizadores industriales y reactivos analíticos. Los compuestos de coordinación también se utilizan ampliamente en galvanoplastia, teñido de textiles y química médica.
Algunos ejemplos de compuestos coordinados son:
- Tetracarbonilníquel (0) – [Ni(CO) 4 ]
- Tetrahidroxidozincato(II) de potasio – K 2 [Zn(OH) 4 ]
- Cloruro de pentaaminocarbonatocobalto(III) – [Co(NH 3 ) 5 (CO 3 )]Cl
- Diaminacloridonitrito-N-platino(II) – [Pt(NH 3 ) 2 Cl(NO 2 )]
Isomería en compuestos de coordinación
Los isómeros son dos o más compuestos con la misma fórmula química pero diferente disposición atómica. Se diferencian en una o más propiedades físicas o químicas debido a la diferente disposición de los átomos. Entre los compuestos de coordinación, hay dos tipos principales de isomería.
- estereoisomerismo
- Isomería estructural
estereoisomerismo
Los estereoisómeros tienen la misma fórmula química y enlaces químicos, pero su disposición espacial es diferente.
- Isomería geométrica
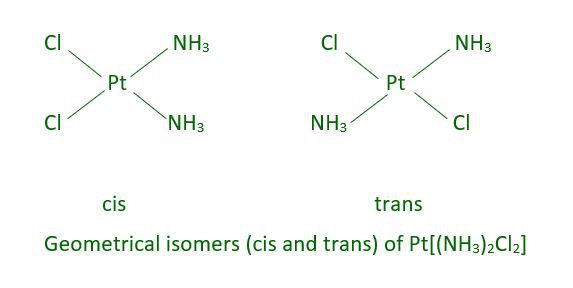
Debido a los diversos arreglos geométricos de los ligandos, este tipo de isomería ocurre en los complejos heterolépticos. Los números de coordinación 4 y 6 proporcionan ejemplos notables de este comportamiento. Los dos ligandos X en un complejo planar cuadrado de fórmula [MX 2 L 2 ] (X y L no están identificados) pueden disponerse uno al lado del otro en un isómero cis o uno opuesto al otro en un isómero trans.
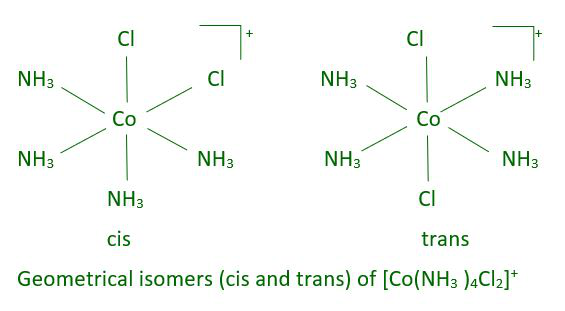
Otros complejos planos cuadrados del tipo MABXL (donde M es metal y A, B, X, L son ligandos no identificados) exhiben tres isómeros, dos cis y uno trans. Tal isomería no es posible para una geometría tetraédrica, pero un comportamiento similar es posible en complejos octaédricos de fórmula [MX 2 L 4 ] ] en los que los dos ligandos X pueden estar orientados cis o trans entre sí.
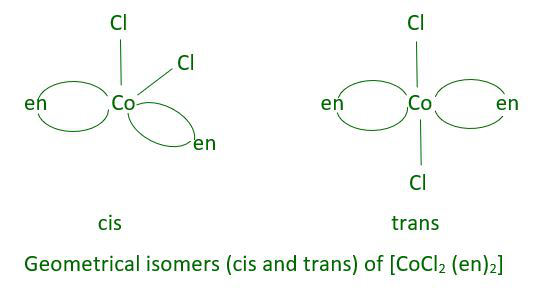
Este tipo de isomería también se conoce como isomería geométrica cuando los ligandos didentados L – L [p. ej., NH 2 CH 2 CH 2 NH 2 (en)] están presentes en complejos de fórmula [MX 2 (L– L) 2 ].
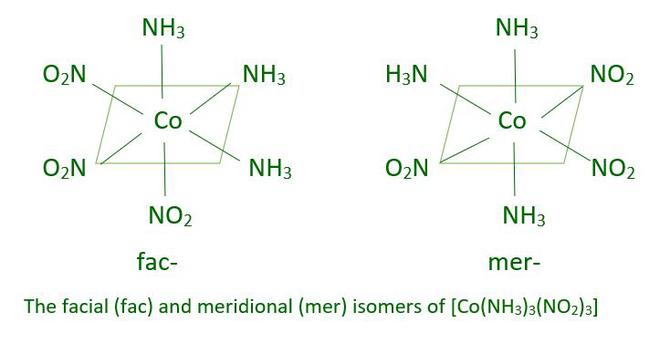
Otro tipo de isomería geométrica ocurre en entidades de coordinación octaédrica del tipo [Ma 3 b 3 ] como [Co(NH 3 ) 3 (NO 2 ) 3 ]. El isómero facial (fac) se forma cuando tres átomos donantes del mismo ligando ocupan posiciones adyacentes en las esquinas de una cara octaédrica. El isómero meridional (mer) se obtiene cuando las posiciones están centradas en el meridiano del octaedro.
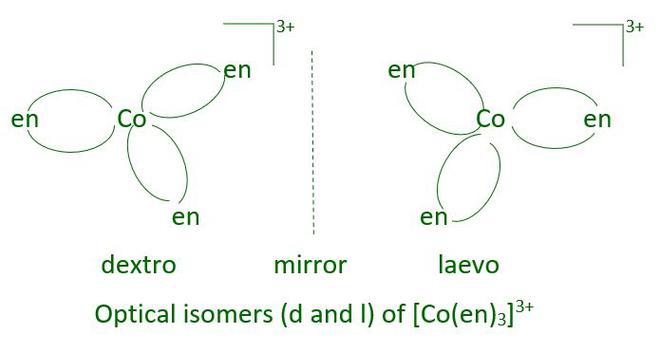
- Isomería óptica:
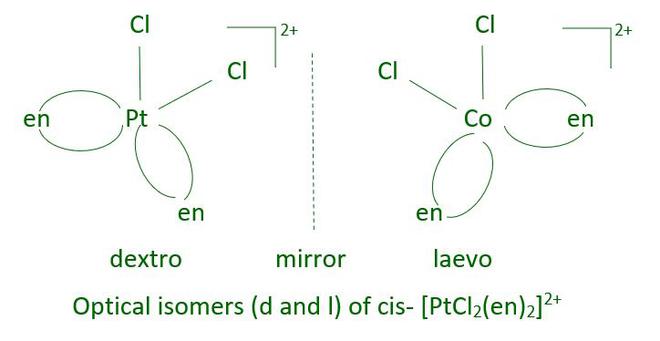
Las imágenes especulares que no se pueden superponer entre sí son isómeros ópticos. Estos se conocen como enantiómeros. Las moléculas o iones quirales son aquellas que no se pueden superponer. Las dos formas se llaman dextro (d) y laevo (l) dependiendo de la dirección en que giran el plano de luz polarizada en un polarímetro (d gira hacia la derecha, l hacia la izquierda). En los complejos octaédricos que contienen ligandos didentados, la isomería óptica es común.
En una entidad de coordinación del tipo [PtCl 2 (en) 2 ] 2+ , solo el isómero cis muestra actividad óptica.
Isomería estructural
- Isomería de enlace:
En un compuesto de coordinación que contiene un ligando ambidentado, se produce isomería de enlace. Los complejos que contienen el ligando tiocianato, NCS–, brindan un ejemplo simple, ya que puede unirse a través del nitrógeno para dar M–NCS o a través del azufre para dar M–SCN. Este tipo de comportamiento se muestra en el complejo [Co(NH 3 ) 5 (NO 2 )]Cl 2 , que se obtiene como la forma roja, en la que el ligando nitrito se une a través del oxígeno (–ONO), y como la forma amarilla forma, en la que el ligando nitrito se une a través de nitrógeno (-NO 2 ).
Ejemplos:
- de color violeta [(NH 3 ) 5 Co-SCN] 2+ y de color naranja [(NH 3 ) 5 Co-NCS] 2+
- [Co(ONO)(NH 3 ) 5 ]Cl : el isómero de nitrito -O unido y [Co(NO 2 )(NH 3 ) 5 ]Cl : el isómero de nitro – N unido
- Isomería de coordinación:
El intercambio de ligandos entre entidades catiónicas y aniónicas de diferentes iones metálicos presentes en un complejo provoca isomería de coordinación. [Co(NH 3 ) 6 ][Cr(CN) 6 ], en el que los ligandos NH3 están unidos a Co 3+ y los ligandos CN– a Cr 3+ . En su isómero de coordinación [Cr(NH 3 ) 6 ][Co(CN) 6 ], los ligandos NH 3 están unidos a Cr 3+ y los ligandos CN – a Co 3+ .
Ejemplos:
- [Co(NH 3 ) 6 ][Cr(C 2 O 4 ) 3 ] y [Co(C 2 O 4 ) 3 ][Cr(NH 3 ) 6 ]
- [Zn(NH 3 ) 4 ][Cu(Cl 4 )] y [Cu(NH 3 ) 4 ][Zn(Cl 4 )]
- Isomería de ionización:
La isomería de ionización ocurre cuando el contraión en una sal compleja es un ligando potencial en sí mismo y puede desplazar a un ligando, que luego puede convertirse en el contraión. Un ejemplo lo proporcionan los isómeros de ionización [Co(NH 3 ) 5 (SO 4 )]Br y [Co(NH 3 ) 5 Br]SO4 .
Ejemplos:
- [Co(NH 3 ) 5 Cl]SO 4 y [Co(NH 3 ) 5 (SO 4 )]Cl
- [CoBr(H 2 O) 5 ] + Cl – y [CoCl(H 2 O) 5 ] + Br –
- Isomería de solvato:
La isomería de solvato se conoce como ‘isomería de hidrato’, en esta isomería el agua está involucrada como solvente. Esto es similar a la isomería de ionización. La diferencia entre los isómeros de sulfato es si la molécula de solvente está unida directamente al ion metálico o si está presente en la red cristalina como moléculas de solvente libres. El complejo aqua [Cr(H 2 O) 6 ]Cl 3 (violeta) y su isómero solvatado [Cr(H 2 O) 5 Cl]Cl 2 .H 2 O son dos ejemplos (gris-verde).
Ejemplos:
- [CrCl 2 (H 2 O) 4 ]Cl.2H 2 O : color verde brillante
- [CrCl(H 2 O) 5 ]Cl 2 .H 2 O: color gris verdoso
- [Cr(H 2 O) 6 ]Cl 3 : color violeta
Pregunta resuelta:
Pregunta 1: Dibuja todos los isómeros geométricos de [Fe(NH 3 ) 2 (CN) 4 ] – .
Responder:
Pregunta 2: Indique los tipos de isomería que presentan los siguientes complejos
- [Co(en) 3 ]Cl 3
- [Co(NH 3 ) 5 (NO 2 )](NO 3 ) 2
- [Pt(NH 3 )(H 2 O)Cl 2 ]
Responder:
- [Co(en) 3 ]Cl 3 —-> Isomería óptica
- [Co(NH 3 ) 5 (NO 2 )](NO 3 ) 2 —-> Isomería óptica, Isomería de enlace, Isomería de ionización
- [Pt(NH 3 )(H 2 O)Cl 2 ] —-> Isomería geométrica (cis-, trans-)
Pregunta 3: ¿Cuántos isómeros geométricos habrá en [Co(NH 3 ) 3 (Cl) 3 ]?
Responder:
Dos isómeros geométricos son posibles para [Co(NH 3 ) 3 (Cl) 3 ] –
Pregunta 4: ¿Qué son los ligandos en los compuestos de coordinación?
Responder:
Los ligandos son iones o moléculas que se unen al átomo/ión central de la entidad de coordinación. Iones simples como Cl–, moléculas pequeñas como H2O o NH3, moléculas más grandes como H 2 NCH 2 CH 2 NH 2 o N(CH 2 CH 2 NH 2 ) 3 , e incluso macromoléculas como proteínas pueden entrar en esta categoría.
Pregunta 5: Dibuje los isómeros geométricos de [Pt(NH 3 )(Br)(Cl)(py)] ?
Responder:
Publicación traducida automáticamente
Artículo escrito por naimishsahu08 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA