En química, las masas molares anormales ocurren cuando las masas molares se estiman y son más altas o más bajas que el valor predicho. Las cualidades coligativas se utilizan para calcularlas. La elevación del punto de ebullición, la disminución de la presión de vapor relativa, la depresión del punto de congelación y el alivio de la presión osmótica son todas propiedades coligativas. La palabra anormal está en el nombre, lo que implica que la forma en que se calculan las masas molares, utilizando el factor de Van’t Hoff, es anormal. Echemos un vistazo.
Masas molares anormales
Las masas molares determinadas por estos métodos no concuerdan con los valores esperados o teóricos. El valor exacto de la masa molar se puede obtener solo si se cumplen las siguientes dos condiciones.
- Las soluciones deben diluirse: Las soluciones utilizadas para medir las propiedades coligativas no deben estar demasiado concentradas. En soluciones concentradas, las partículas interactúan entre sí y con el solvente. Como resultado, la presión de vapor y, por lo tanto, otras propiedades conjugadas dependen de la naturaleza del soluto, no solo del número de partículas de soluto.
- El soluto requerido no está separado o colaborativo en la solución: Las ecuaciones derivadas para medir las propiedades coligativas son para solutos no electrolíticos que no experimentan ninguna disociación o tienen una solución de asociación. Sin embargo, surgen discrepancias en la determinación de la masa molar cuando los solutos se disocian o se asocian con la disolución en un solvente. Esto se debe a que el número de moléculas en una solución cambia debido a la adición o disociación de moléculas de soluto. Por lo tanto, las masas molares anormales se obtienen como se explica a continuación:
Para sustancias que experimentan asociación, disociación, etc. en solución, la masa molecular determinada por las propiedades conjugadas difiere del valor esperado. Esto se conoce como masa molecular anormal. Esto se puede saber por el factor medio de Van’t.
Por lo tanto, cuando se calculan a partir de las propiedades coligativas de las soluciones, a veces se encuentra que los valores teóricos de la masa molecular difieren de los valores medidos empíricamente conocidos como masas molares anormales.
Asociación de partículas de soluto
En algunos solventes, generalmente no polares, las moléculas de soluto se unen, es decir, dos, tres o incluso más moléculas interactúan entre sí para formar moléculas más grandes. Por ejemplo, suponga que n moléculas simples se combinan para formar una molécula asociada:
nA ⇆ A n
(moléculas individuales) (una molécula)
En consecuencia, el número total de moléculas en la solución se vuelve menor que el número de moléculas de la sustancia añadida y, por lo tanto, las propiedades covalentes serán menores. Dado que las propiedades coligativas son inversamente proporcionales a la masa molar del soluto, en tales casos la masa molar excede los valores teóricos. Por ejemplo, en el solvente de benceno, tanto el ácido etanoico (ácido acético) como el ácido benzoico existen como dímeros:

Las masas molares de los dímeros ácido etanoico y ácido benzoico son aproximadamente 120 y 244, que son casi el doble de sus valores normales de 60 y 122, respectivamente. El enlace de las moléculas de soluto en una solución es normal debido al enlace de hidrógeno entre estas moléculas. A modo de ilustración, el ácido benzoico y el ácido etanoico (ácido acético) existen como dímeros debido a la fabricación de enlaces de hidrógeno.
Disociación de moléculas de soluto
Las moléculas de electrolitos (ácidos, bases y sales) se separan o ionizan en un respiradero para dar dos o más partículas. Por ejemplo, AB se disocia para dar un ámbar doble de partículas:
AB ⇆ A + + B –
Como resultado, el número total de partículas en la solución aumenta y, por lo tanto, las propiedades coligativas de dichas soluciones serán grandes. Dado que las propiedades coligativas son inversamente proporcionales a la masa molar, la masa molar observada será menor que el valor teórico. Por ejemplo, KCI, K. dejar de lado para dar iones de Cl ed.
KCI ⇆ K + + Cl –
Esto significa que si disolvemos 1 mol de KCl (74,5 g) en agua, esperamos 1 mol de K y 1 mol de iones Cl – en la solución. Entonces, en lugar de 1 mol de la solución, habrá 2 moles de partículas. Como resultado, las propiedades colaterales también serán casi el doble de lo esperado. Por ejemplo, si E ignora la atracción interiónica, 1 mol de KCl en 1 kg de agua aumentará el punto de ebullición en 2 x 0,52 K (K = 0,52 Km¹) = 1,04 K. Claramente, la masa molar de la sal debe ser aproximadamente la mitad de su valor normal, es decir, 37,25.
Factor de Van’t Hoff
El factor de Van’t Hoff se define como la relación entre la masa molar normal y la masa molar observada (o masa molar anormal) del soluto, es decir, i = masa molar normal/masa molar observada (o anormal)
- En el caso de una asociación, la masa molar observada es mayor a la normal, el factor T tiene un valor menor a 1.
- En el caso de la disociación, el factor de Van’t Hoff es mayor a 1 porque la masa molar observada tiene un valor menor.
- En el caso de solutos que no sufran ninguna asociación o disociación en un solvente, el factor de Van’t Hoff será igual a 1 porque las masas molares observadas y normales serán las mismas.
Dado que la masa molar es inversamente proporcional a la propiedad coligativa, el factor de Van’t Hoff también se puede definir como la relación entre el valor observado de la propiedad coligativa y el valor ordinario de la propiedad coligativa.
i = Valor observado de la propiedad coligativa / Valor normal de la propiedad coligativa
o
i = Número total de moles de partículas después de la asociación o disociación / Número total de moles de partículas antes de la asociación o disociación
Si i > 1, el soluto sufre disociación y si i < 1, el soluto sufre asociación.
- por asociación ,
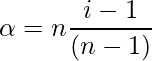
donde, n = número de partículas asociadas o disociadas.
- Por disociación ,
![]()
El factor de Van’t Hoff siempre será mayor que 1 para los solutos disociados. El factor de Van’t Hoff se establece en 1 para partículas que no muestran asociación ni disociación. Así, después de incorporar el factor de Van’t Hoff, la ecuación de propiedades coligativas será,
- La inclusión del factor de Van’t Hoff modifica las ecuaciones de las propiedades coligativas de la siguiente manera:
- Disminución relativa de la presión de vapor del disolvente, (p 1 ° -p 1 )/p 1 ° = i(n 2 /n 1 )
- Elevación en el punto de ebullición, ΔT b = iK b m
- Depresión en el punto de congelación, ΔT f = iK f m
- La presión osmótica de la solución, π = (en 2 /V) RT
Ejemplos de preguntas
Pregunta 1. ¿Por qué se tiene mucho cuidado al inyectar por vía intravenosa a la misma concentración que en los vegetales y en una solución de plasma sanguíneo?
Responder:
Durante la inyección intravenosa, la concentración de la solución inyectable debe ser igual a la del plasma sanguíneo. Si la solución está menos concentrada, su presión osmótica será menor. El agua intentará ingresar a los glóbulos rojos a través de las paredes celulares. Como resultado, las células se hincharán y estallarán. Por otro lado, si la solución es más concentrada, el agua de las células intentará pasar a la solución más concentrada fuera de la célula por ósmosis. Esto hace que las células se encojan y, en consecuencia, dejen de funcionar.
Pregunta 2. ¿Qué propiedad coligativa se privilegia para caracterizar la masa molar de las macromoléculas?
Responder:
Se prefiere premeditar la presión osmótica para completar todas las demás propiedades conjugadas porque:
- Incluso en soluciones diluidas, los valores de presión osmótica son muy altos y pueden medirse con precisión.
- La presión osmótica se puede premeditar a temperatura ambiente. Por otro lado, la altura del punto de ebullición se mide a la temperatura más alta donde el soluto puede disociarse. La depresión en el punto de congelación se mide a baja temperatura.
Pregunta 3. Si se disuelven 0,1 mol de azúcar o 0,1 mol de glucosa en un litro de agua, ¿la depresión en el punto de congelación será igual o diferente?
Responder:
La depresión en el punto de congelación será la misma en ambas soluciones, ya que ambas no son electrolitos y dan la misma cantidad de partículas de soluto.
Pregunta 4. Se quitan las cáscaras duras exteriores de los dos huevos. Se coloca un huevo en agua pura y el otro en una solución saturada de cloruro de sodio. ¿Qué se verá y por qué?
Responder:
Un huevo colocado en agua se hinchará debido a la ósmosis de agua pura en el huevo. Por otro lado, un huevo colocado en una solución saturada de NaCl se encogerá debido a la ósmosis del agua del huevo. Esto se debe a que la ósmosis siempre ocurre desde una alta concentración de solvente a una baja concentración de solvente.
Pregunta 5. ¿Por qué se recomienda mezclar etilenglicol con agua en el radiador de un automóvil mientras se conduce en una estación de montaña?
Responder:
El etilenglicol reduce el punto de congelación del agua y, por lo tanto, no se congela en una estación de montaña.
Pregunta 6. Una solución de cloruro de sodio se congela a una temperatura más baja que el agua pero hierve a una temperatura más alta que el agua, explique.
Responder:
El punto de congelación de un líquido disminuye con la adición de un soluto no volátil y, por lo tanto, una solución de cloruro de sodio se congela a una temperatura inferior al punto de congelación del agua. La adición de un soluto no volátil como reemplazo aumenta el punto de ebullición y da como resultado el punto de ebullición de una solución de cloruro de sodio.
Pregunta 6. ¿Son isotónicas las soluciones ecuatoriales de cloruro de sodio y urea? ¿Por qué?
Responder:
El cloruro de sodio se disocia en dos iones (Na y Cl) y ejerce aproximadamente el doble de la presión osmótica de la urea 170 (que no es un electrolito).
Publicación traducida automáticamente
Artículo escrito por tanushree7252 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA