Dado que el carbono juega un papel tan importante en la química de los organismos vivos, todos están basados en el carbono. Esto sugiere que los átomos de carbono, unidos a otros átomos de carbono u otros elementos, son los componentes básicos de muchos, si no todos, los compuestos que se encuentran solo en los seres vivos. Otros átomos juegan papeles vitales en las moléculas biológicas, pero el carbono es, sin duda, el elemento «fundamental» para los organismos vivos. Las características de enlace de los átomos de carbono son responsables de su importancia significativa.
Carbón
El carbono con número atómico 6, tiene la configuración (2,4) con cuatro electrones de valencia en la capa de valencia. Para lograr la estabilidad, el carbono debe tener la configuración de gas noble de los gases nobles o inertes que están más cerca de él.
El átomo de carbono es uno de los pocos elementos que tiene la capacidad de establecer grandes redes de conexiones covalentes tanto con otros elementos como consigo mismo. El carbono no es un elemento electropositivo ni electronegativo debido a su posición en la segunda fila horizontal de la tabla periódica; como resultado, es más probable compartir electrones que ganarlos o perderlos.
Debido a que puede mezclarse consigo mismo y con muchos otros elementos, el carbono es un «ingrediente» relativamente común de la materia. Puede producir una amplia gama de compuestos, con tamaños que van desde unos pocos átomos hasta miles de átomos. El carbono es el único elemento que puede producir tantos compuestos distintos, y se conocen millones de ellos.
Electrones de valencia en carbono
El carbono es un no metal del grupo 14 de la tabla periódica. El carbono, al igual que los demás elementos del grupo 14, tiene cuatro electrones de valencia. Los electrones en el nivel de energía exterior de un átomo que participan en enlaces químicos se conocen como electrones de valencia. El diagrama de puntos de electrones en la Figura a continuación representa los electrones de valencia del carbono.

Carbono con cuatro electrones de valencia
Para llenar su nivel de energía exterior, el carbono requiere cuatro electrones de valencia más, para un total de ocho electrones de valencia. La disposición más estable de electrones es un nivel de energía exterior total. El carbono puede formar cuatro enlaces covalentes. Los enlaces químicos entre no metales se conocen como enlaces covalentes. Dos átomos comparten un par de electrones en un enlace covalente. El carbono comparte cuatro pares de electrones al establecer cuatro enlaces covalentes, llenando así su nivel de energía exterior y asegurando la estabilidad.
¿Cómo forma el carbono enlaces covalentes?
Se dice que el gas es un gas noble en la naturaleza si tiene 8 electrones en su capa de valencia o dos electrones en su capa de valencia en el caso del helio. Los gases nobles también se denominan gases inertes o gases estables porque son de naturaleza estable. Cada átomo trata de alcanzar una configuración de gas noble a través de enlaces.
Los gases nobles más cercanos al carbono son el helio (He = 2) y el neón (Ne = 2, 8) son los gases inertes más cercanos al carbono. Ahora, el carbono tiene dos opciones para alcanzar esta configuración, ya sea ganando cuatro electrones (logrando la configuración Ne) o perdiendo 4 electrones (logrando la configuración He). Pero ambas opciones con la formación de enlaces iónicos no son factibles porque:
- Formación de Anión de Carbono por la ganancia de cuatro electrones: Al ganar cuatro electrones, el carbono se convierte en un Anión C- 4 .

anión de carbono
Los aniones son iones cargados negativamente que se forman cuando el átomo tiene más electrones que protones. Aquí, el carbono tiene 6 protones y 10 electrones.
Aunque el carbono alcanza la configuración Ne, se vuelve difícil para el núcleo contener diez electrones con seis protones. Entonces, es inestable y esta unión no se lleva a cabo.
- Formación del Catión Carbono por la pérdida de cuatro electrones: Al perder cuatro electrones, el carbono se convierte en Catión C + 4.

catión de carbono
Los cationes son iones cargados positivamente que se forman cuando el átomo tiene más protones que electrones. Aquí, el carbono tiene 6 protones y 2 electrones.
Aunque el carbono alcanza la configuración He, se vuelve difícil para el núcleo contener dos electrones con seis protones. Entonces, es inestable y esta unión no se lleva a cabo.
Estas dos razones no apoyan la formación de Enlaces Iónicos en el caso del Carbono. Entonces, para su rescate, Carbon completa su octeto compartiendo electrones y completando su octeto. Se sabe que este tipo de enlace en el que el elemento completa su octeto compartiendo electrones es de naturaleza covalente.
Por lo tanto, el carbono siempre forma enlaces covalentes.
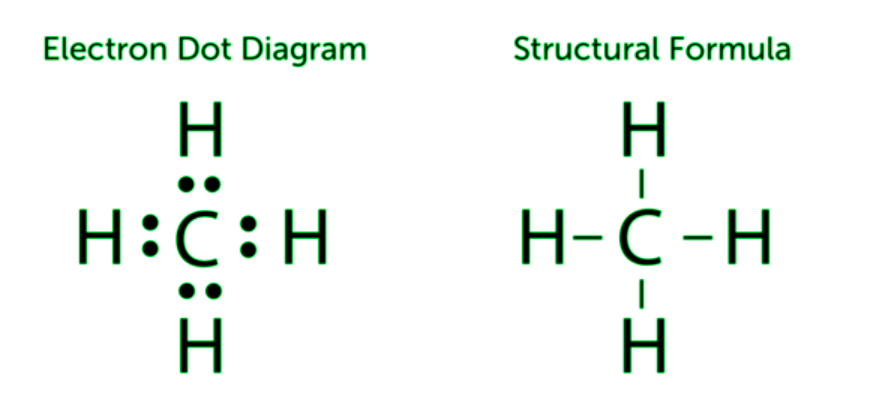
Los enlaces covalentes se pueden formar entre átomos de carbono o entre átomos de carbono y los átomos de otros elementos. El carbono y el hidrógeno frecuentemente forman enlaces. Los hidrocarburos son compuestos que simplemente contienen carbono e hidrógeno. Un hidrocarburo es algo así como el metano (CH 4 ), que se representa en el siguiente diagrama. Un átomo de carbono forma conexiones covalentes con cuatro átomos de hidrógeno en el metano. Todos los electrones de valencia compartidos se representan a la izquierda en el siguiente diagrama. Cada par de electrones compartidos está representado por un guión (-) en la figura de la derecha en la figura siguiente, que se denomina fórmula estructural.
Ejemplos de preguntas
Pregunta 1: ¿Cuáles son el número atómico y la configuración atómica del carbono?
Responder:
El carbono posee número atómico 6 y tiene configuración 2,4.
Pregunta 2: ¿Puede el carbono formar enlaces iónicos? En caso afirmativo, dé un ejemplo.
Responder:
El carbono no puede formar enlaces iónicos. Solo forma enlaces covalentes con otros átomos.
Pregunta 3: Defina enlace covalente.
Responder:
Los enlaces en los que no hay pérdida ni ganancia de electrones y la formación de enlaces tiene lugar compartiendo electrones se denominan enlaces de naturaleza covalente o simplemente enlaces covalentes.
Pregunta 4: Dé ejemplos de carbono con formación de enlaces covalentes.
Responder:
CO 2 , CCL 4 , CH 4 son ejemplos de carbono que forma enlaces covalentes con otros átomos.
Pregunta 5: Explique la formación de enlaces de CO 2 . ¿Qué tipo de enlace tiene lugar entre los átomos de CO 2 ? Explique esquemáticamente su formación de enlaces.
Responder:
La naturaleza del enlace entre los átomos de CO 2 es de naturaleza covalente. El carbono y el oxígeno comparten electrones entre ellos y no hay intercambio de electrones. El carbono tiene 4 electrones en su capa de valencia y comparte sus electrones con el oxígeno que tiene 6 electrones en su capa de valencia. De esta manera, hay un intercambio de electrones entre los átomos que tiene lugar en el CO 2.
La representación esquemática de la formación de enlaces CO 2 se representa a continuación:

Formación de CO2 por enlace covalente de carbono con oxígeno
Publicación traducida automáticamente
Artículo escrito por riarawal99 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA