Los alcoholes, el fenol y los éteres tienen varias aplicaciones en los negocios y en la vida cotidiana. Los alcoholes y los fenoles son sustancias orgánicas hidroxiladas. El pulimento para madera que utilizamos para pulir nuestros muebles está compuesto por alcohol, que en su mayor parte es etanol. El mentol, derivado del aceite de menta, se usa para dar sabor a cigarrillos y alimentos. Además, a partir de alcoholes, se pueden sintetizar una variedad de compuestos orgánicos como haluros de alquilo, alquenos, aldehídos, cetonas, ácidos carboxílicos, éteres, etc. Los compuestos hidroxi orgánicos se encuentran en la caña de azúcar, la ropa de algodón y el papel para escribir.
Debido a que los éteres son químicamente inertes, a menudo se utilizan como solventes en una amplia gama de procesos químicos. El éter dietílico, el miembro más frecuente de la familia de los éteres, se usó como anestésico quirúrgico durante muchos años hasta que fue reemplazado por alternativas no inflamables más seguras. En perfumería se utiliza el anisol, un éter aromático de olor agradable.
Los éteres son derivados de hidrocarburos en los que un grupo alcoxi (-OR) o ariloxi (-OAr) reemplaza un átomo de hidrógeno. Los éteres también son sustancias creadas al reemplazar el átomo de hidrógeno del grupo hidroxilo de un alcohol o fenol con un grupo alquilo o arilo.
- Los éteres son derivados orgánicos del agua con dos grupos alquilo o arilo unidos a un átomo de oxígeno. Los éteres también se conocen como rusts de alquilo (R 2 O) u rusts de arilo (AR 2 O).
- La fórmula general del éter alifático es C n H 2n+2 O.
- Es el mismo que el de los alcoholes monohídricos. Por lo tanto, los éteres alifáticos son isómeros de los alcoholes monohídricos.
Clasificaciones de éter
Los éteres se clasifican básicamente en dos grupos éteres simples o mixtos.
- Éteres simples o simétricos: los éteres en los que los grupos alquilo o arilo unidos a los átomos de oxígeno son iguales se denominan éteres simples.
por ejemplo: éter dimetílico (CH 3 – O – CH 3 ), éter difenílico (CH 6 – O – CH 6 ), etc.
- Éteres mixtos o asimétricos: Los éteres en los que dos grupos alquilo o arilo unidos a átomos de oxígeno son diferentes se denominan éteres mixtos.
ej.: Etil metil éter (CH 3 – O – C 2 H 5 ). etc.
Estructura del éter
Los éteres también tienen la misma geometría tetraédrica que el agua. El átomo de oxígeno tiene hibridación sp3 . Debido a la interacción repulsiva entre los dos grupos alquilo más voluminosos, el ángulo del enlace C – O – C es ligeramente mayor que el ángulo tetraédrico.

Estructura del éter dimetílico
- Metamerismo: Se dice que los éteres con la misma fórmula química pero distintos grupos alquilo unidos a cada lado del átomo de oxígeno son metámeros entre sí. Los metámeros son isómeros de string o isómeros de posición que contienen el mismo grupo funcional pero distintos grupos alquilo unidos al heteroátomo; en este ejemplo, oxígeno.
ej.: CH 3 – CH 2 – O – CH 2 – CH 3 (éter dimetílico) y CH 3 – O – CH 2 – CH 2 – CH 3 (metil n-propil éter).
- Isomería: La isomería se refiere a la presencia de moléculas que contienen el mismo número de átomos del mismo tipo y, por lo tanto, la misma fórmula, pero difieren en características químicas y físicas. Los éteres exhiben básicamente dos tipos de isomería:
- Isomería de string: los isómeros de string son éteres que tienen grupos alquilo idénticos a cada lado del átomo de oxígeno pero diferentes configuraciones de la string de carbono dentro del grupo alquilo.
- Isomería funcional : los isómeros funcionales son éteres y alcoholes monohídricos con el mismo número de átomos de carbono.
Preparaciones de Éteres
Por deshidratación intermolecular:
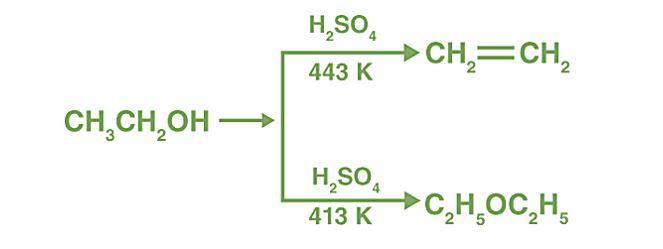
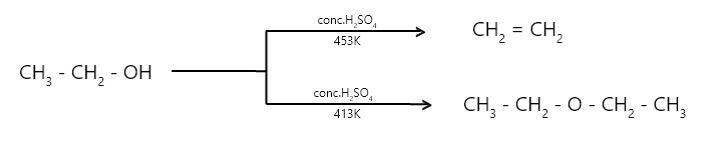
Cuando se destila un exceso de alcohol etílico con ácido sulfúrico concentrado a 413 K, se produce éter dietílico. es decir, de alcoholes también llamados deshidratación intermolecular.
Si se ve experimentalmente entonces,
- Los primeros volúmenes iguales de alcohol etílico y ácido sulfúrico concentrado se colocan en un matraz de destilación.
- Aquí el alcohol etílico reacciona con ácido sulfúrico concentrado para dar hidrogenosulfato de etilo.
C 2 H 5 −OH + H−O−SO 3 H ⟶ C 2 H 5 −O−SO 3 H + H 2 O
- Ahora, el exceso de alcohol etílico se agrega al matraz de destilación.
- Aquí, el hidrogenosulfato de etilo reacciona con el alcohol etílico añadido para dar éter dietílico.
C 2 H 5 −O−SO 3 H + H−O−C 2 H 5 ⟶ C 2 H 5 −O−C 2 H 5 + H 2 SO 4
- El éter producido se destila y el ácido sulfúrico generado en la segunda reacción se reutiliza en el primer paso.
También se conoce como el proceso de eterificación continua porque una pequeña cantidad de ácido sulfúrico convierte un volumen significativo de alcohol etílico en éter dietílico y el proceso continúa.
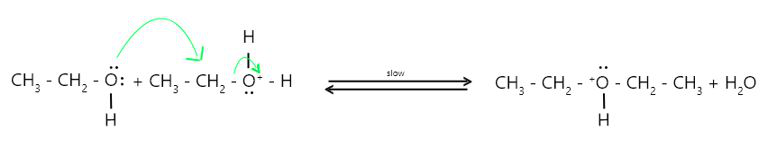
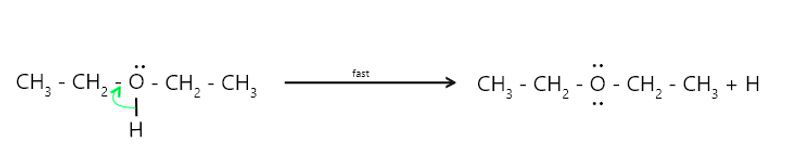
Mecanismo de reacción:
- Paso 1: Formación de alcohol protonado-
- Paso 2 : Ataque nucleofílico-
- Paso 3 : Desprotonación
Las limitaciones de la reacción anterior son:
- El proceso es exclusivamente adecuado para preparar éteres a partir de alcoholes primarios.
- La deshidratación de alcoholes secundarios y terciarios, por otro lado, produce alquenos en lugar de éteres, ya que la eliminación triunfa sobre la sustitución.
- Dos procesos compiten entre sí en la deshidratación ácida de alcoholes. Una reacción es la eliminación, que produce alquenos, mientras que la otra es una sustitución, que produce éteres.
Ahora, estas dos reacciones en competencia se pueden controlar. A medida que aumenta la temperatura, la temperatura se vuelve más propicia para la eliminación (453 K y más). Pero a 413 K y menos, se prefiere la sustitución.
- Este enfoque es útil para producir éteres simples. La deshidratación bimolecular de alcoholes es ineficaz para la síntesis de éteres mixtos. Cuando se combinan dos alcoholes distintos, se forma una mezcla de tres éteres diferentes, que es difícil de separar.
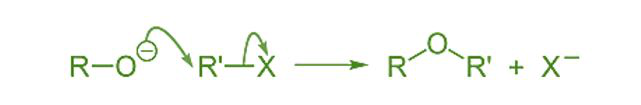
Síntesis de Williamson
Mediante el uso de la síntesis de Williamson, se pueden preparar éteres simples y mixtos, utilizando un haluro de alquilo. Cuando el haluro de alquilo se calienta con alcrust alcohólico de sodio o de potasio, da éter.
La forma general se escribe como,
Algunos de los ejemplos importantes de la síntesis de Williamson son los siguientes:
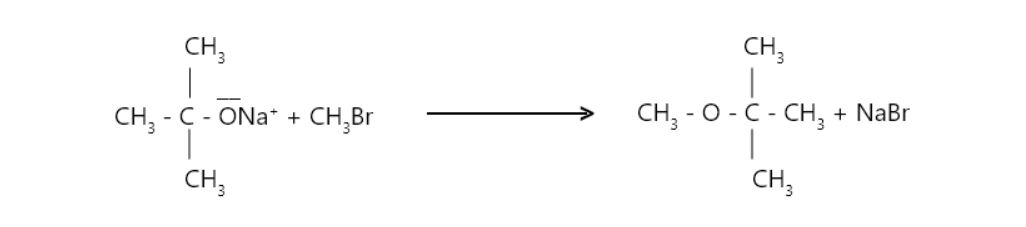
- La preparación de t-butil metil éter debe realizarse mediante la siguiente reacción.
- Los fenoles también se convierten en éteres utilizando este método.
Aunque usando la síntesis de Williamson podemos obtener éteres simples y mixtos, pero también hay limitaciones,
Limitaciones:
- Se requiere una elección adecuada de reactivos para la síntesis de éteres asimétricos. Debido a que los haluros de alquilo primarios son más sensibles a la reacción SN3, el mayor rendimiento de éter asimétrico se produce cuando el haluro de alquilo es primario y el alcrust es terciario.
- por ejemplo: el terc-butil etil éter se prepara calentando bromuro de etilo con terc-butrust de sodio.
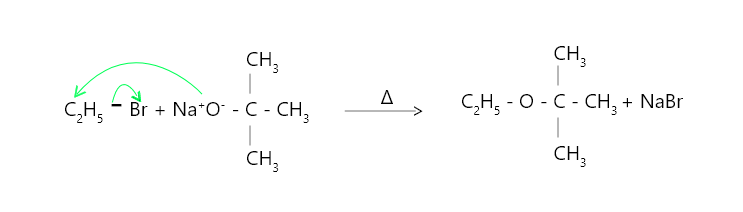
- Sin embargo, cuando el haluro de alquilo es secundario o terciario, el ataque nucleofílico sobre el átomo de carbono α es estéricamente problemático (efecto de hacinamiento). Además, debido a que el alcrust es una base más fuerte y ataca al ß-hidrógeno más fácilmente, predomina la ß-eliminación.
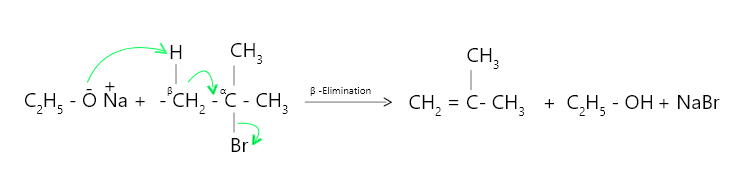
Ejemplos de preguntas
Pregunta 1: ¿Dé ejemplos de éteres simples y mixtos?
Responder:
- Éter simple: C 2 H 5 – O – C 2 H 5 Éter dietílico
- Éter mixto: CH 3 – O – C 2 H 5 Etil metil éter
Pregunta 2: Dar la estructura del siguiente compuesto:
- 1 – Metoxietano
- 1 – etoxietano
Responder:
- 1 – Metoxietano
CH 3 – O -C 2 H 5
- 1 – etoxietano
C 2 H 5 – O – C 2 H 5
Pregunta 3: ¿Qué es el metamerismo? Explique con referencia a los éteres.
Responder:
El metamerismo es un tipo de isomería estructural en el que dos o más compuestos tienen la misma fórmula química pero tienen un grupo funcional polivalente unido a grupos alquilo separados.
Los diversos compuestos se denominan metámeros.
ej.: La fórmula C 4 H 10 O representa dos éteres diferentes que son los metámeros.
- Éter dietílico: CH 3 – CH 2 – O -CH 2 – CH 3
- Metil-n-propiléter: CH3 – O – CH 2 – CH 2 – CH 3
Pregunta 4: Escriba una nota sobre el proceso de eterificación continua.
Responder:
Cuando se calienta un exceso de un alcohol inferior con H 2 SO 4 concentrado a 413 K, se genera un intermedio que interactúa con la segunda molécula de alcohol para dar éter. El éter dietílico se genera cuando se calienta un exceso de alcohol etílico con agua conc. H2SO4 a 413 K. _
El H 2 SO 4 se regenera con esta técnica y se combina con cantidades crecientes de alcohol para formar éter. Como resultado, se conoce como el proceso de eterificación continua.
Sin embargo, este enfoque solo es adecuado para la síntesis de éteres simples, preferiblemente a partir de alcoholes primarios.
Publicación traducida automáticamente
Artículo escrito por lunaticgemini2510 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA