La evaporación es el proceso de separación de una sustancia sólida que se disuelve en agua. La aplicación se basa en el hecho de que los sólidos no se vaporizan fácilmente, mientras que los líquidos sí. Al realizar la evaporación, la sustancia sólida queda como residuo. Es una técnica de vaporización donde el líquido cambia a la fase gaseosa y los residuos en la superficie.
La evaporación continúa hasta que se alcanza el estado de equilibrio. Sin embargo, en un espacio cerrado, un líquido continuará vaporizándose hasta que se alcance la saturación de aire. En la práctica, solo una pequeña fracción del total de moléculas posee la energía térmica necesaria para vaporizarse.

Factores que afectan la tasa de evaporación
- Presión: Menos presión implica una mayor tasa de evaporación. Al ejercer menos presión, las moléculas evitan que se evaporen.
- Temperatura de la sustancia: Al aumentar la temperatura de la sustancia, el material se calienta y las partículas constituyentes comienzan a moverse con mayor energía cinética. Esto conduce a un aumento en la tasa de evaporación. Por ejemplo, el agua caliente hierve más rápido que el agua fría.
- Superficie de la sustancia: dado que cualquier sustancia con un área de superficie más grande contendrá más moléculas de superficie por unidad de volumen, desenstring el potencial de escape de las partículas, lo que aumenta la tasa de evaporación.
- Fuerzas intermoleculares: Las fuerzas intermoleculares más fuertes entre las moléculas del agua en estado líquido conducirán a la aplicación de fuerzas mayores para permitir que las partículas escapen. La entalpía de vaporización proporciona un indicador de las fuerzas intermoleculares.
- Tasa de flujo de la atmósfera: el aire que no está saturado con cualquier tipo de sustancia, por ejemplo, aire fresco, se cierne sobre la sustancia, lo que provocará un aumento en la concentración de la sustancia en el aire. Esto aumenta la tasa de evaporación.
Equilibrio evaporativo
Al llevarse a cabo la evaporación en un espacio cerrado, las moléculas que se vaporizan tienden a acumularse sobre la superficie del líquido. Con un aumento en la densidad y la presión del líquido, más de estas moléculas regresan a la superficie del líquido. También hay un aumento en la frecuencia de estas partículas que regresan.
En equilibrio:
La tasa de evaporación se vuelve equivalente a la tasa de condensación. Tan pronto como el proceso de escape de las moléculas de agua sea equivalente al retorno, se dice que el vapor que escapa está saturado. El sistema alcanza un nivel donde el estado de equilibrio está directamente relacionado con la presión de vapor de la sustancia. En este punto, los siguientes factores permanecen constantes:
- Presión de vapor
- Densidad
- Se producirá la temperatura del líquido.
La relación de Clausius-Clapeyron elabora convenientemente esta relación que pone énfasis en el hecho de que la tasa de evaporación de cualquier líquido guarda relación con la presión de vapor mantenida en el sistema cerrado:
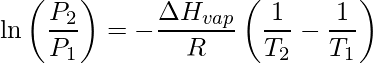
Aquí, P 1 es la presión de vapor asociada con el tiempo T 1 y P 2 en T 2 respectivamente.
R es la constante universal de los gases. ΔH vap se conoce como la entalpía de vaporización
Ventajas de la Separación por Evaporación
- Fabricación de concentradores: Los productores de bebidas pueden crear concentrados, por ejemplo, concentradores de jugo. Los productores de lácteos también utilizan la técnica de la evaporación para usarla para secar la lactosa en polvo.
- El agua que contiene minerales se puede evaporar para extraer los metales y minerales que simulan los procesos químicos. Esto también se puede utilizar para proporcionar alimentación a la caldera.
- El agua de mar se puede evaporar para producir agua potable.
- Se puede utilizar para concentrar la solución mediante la evaporación de la mezcla hirviendo.
- Eliminación de agua de una solución acuosa que contiene una mezcla, por ejemplo, cloruro de sodio, hidrrust de sodio, glicerol, pegamento y leche
Desventajas de la separación por evaporación
- Pérdida de una sustancia en la atmósfera: una de las sustancias generalmente se pierde en la atmósfera al realizar la evaporación. El vapor tiene que ser recondensado para preservarlo.
- Este proceso no es adecuado para sistemas donde los sólidos no son solubles en mezclas.
- Pérdida de energía térmica al someter el sistema al proceso de evaporación.
Aplicaciones de la evaporación
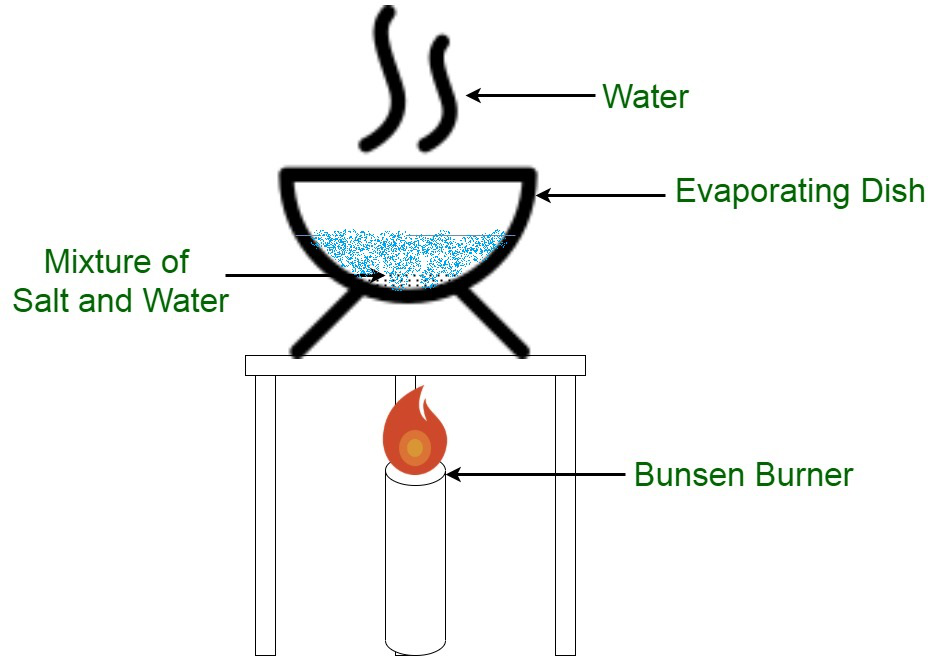
- Separación de la sal común del agua: Se toma una mezcla de sal común y agua en una placa de petri y se somete a calentamiento constante. Cuando el sistema alcanza el estado de evaporación, el agua escapa de la superficie del plato mientras que la sal común permanece en el plato. El líquido que escapa a la superficie no se puede recuperar.
- Separación de azúcar y agua: una mezcla de azúcar y agua se puede separar calentando la mezcla en un plato de porcelana. El azúcar permanece en el recipiente como residuo mientras que el agua se evapora al calentarse hasta el punto de equilibrio. Si el disolvente utilizado es alcohol, el azúcar queda disuelto en agua.
Una mezcla de agua azucarada puede someterse a evaporación para hacer caramelo de roca. - Separación de cristales de sulfato de cobre de soluciones de sulfato de cobre: el compuesto químico de sulfato de cobre es soluble en agua, de modo que sus cristales se disuelven en agua para formar una solución de sulfato de cobre. Cuando evaporamos la mezcla, el agua se evapora y los cristales sólidos de sulfato de cobre quedan como residuo.
- Separación de un componente volátil de uno no volátil.
Ejemplos de preguntas
Pregunta 1: Ilustre el procedimiento paso a paso completo de separación de sodio de la solución de sulfato de sodio.
Responder:
1. Se llena un plato con agua y se agregan unas gotas de ácido sulfúrico diluido.
2. El agua se calienta. Al hervir, se agrega el polvo de sulfato de sodio mientras se agita continuamente.
3. Se agrega el polvo hasta que deja de disolverse más en la mezcla.
4. La solución se filtra y se deja enfriar.
5. Los cristales de sodio se separarán lentamente.
Pregunta 2: ¿Se puede usar la evaporación para separar el tinte del agua?
Responder:
El tinte se conoce como el componente coloreado de la tinta. Al realizar la evaporación, la parte coloreada de la tinta se puede filtrar.
Pregunta 3: Dé un ejemplo de la vida diaria para validar la separación por evaporación.
Responder:
El esmalte de uñas aplicado en la mano se evapora debido a la presencia de la solución líquida, la acetona que contiene.
Pregunta 4: Ilustre una de las principales desventajas de la separación por evaporación.
Responder:
Incurre en un alto uso de recursos tales como capital y energía. También pone una sobrecarga en los costos de mantenimiento. Puede haber dificultades para llevar a cabo el procedimiento debido al gran tamaño del aparato y las temperaturas mejoradas. Algunos de los otros problemas son la corrosión, las incrustaciones y la formación de espuma.
Pregunta 5. Cómo separar el agua de la leche.
Responder:
Midiendo la densidad de la leche y separando el agua por evaporación hasta lograr la densidad deseada.
Pregunta 6. ¿La evaporación en la industria láctea es un paso preliminar a cuál de los siguientes procesos?
- El secado
- Condimento
- Riego
- Pasteurización
Responder:
El secado
La evaporación de la industria láctea se utiliza para tareas de concentración como leche, leche descremada y suero. También se utiliza como paso previo al secado. Los productos lácteos destinados a la leche en polvo normalmente se concentran desde un contenido inicial de sólidos de 9 a 13 % hasta una concentración final de 40 a 50 % de sólidos totales antes de bombear el producto a la secadora.
Pregunta 7. ¿Qué evaporadores se pueden utilizar cuando se requiere un bajo grado de concentración?
Responder:
Los evaporadores de circulación se pueden utilizar cuando se requiere un bajo grado de concentración o cuando se procesan pequeñas cantidades de producto. En la producción de yogur, por ejemplo, la evaporación se utiliza para concentrar la leche de 1,1 a 1,25 veces, o de 13% a 14,5% o 16,25% de contenido de sólidos, respectivamente. Este tratamiento simultáneamente desairea el producto y elimina los sabores desagradables.
Publicación traducida automáticamente
Artículo escrito por yashkumar0457 y traducido por Barcelona Geeks. The original can be accessed here. Licence: CCBY-SA